Una nuova data nel calendario della storia della Medicina
- Articolo del Prof. Sergio Barocci
“Questa autorizzazione offre una nuova opzione per i pazienti idonei che sono in attesa di terapie innovative e mi auguro che i pazienti abbiano accesso a questa terapia il più rapidamente possibile.”
[Professor Josu de la Fuente, Imperial College London]
exagamglogene autotemcel
Il 16novembre 2023 è stata approvata la prima terapia al mondo basata sulla piattaforma di editing genomico CRISPR, coon l’autorizzazione condizionata all’immissione in commercio da parte dall’Ente Regolatorio della Gran Bretagna (MHRA). Si prevede che la Food and Drug Administration (FDA) statunitense seguirà l’esempio nelle prossime settimane, allorchè emetterà una decisione in data dell’8 dicembre. Nel sito ne avevamo già parlato a riguardo quasi sei mesi fa, ricordando la prima somministrazione su un essere umano da parte del dott. Frangoul.
Dal 2012 anno dell’invenzione delle forbici molecolari CRISPR- Cas 9 con la premiazione di Jennifer Doudna ed Emanuelle Charpentier con il Nobel per la Chimica nel 2020, si sono dovuti attendere 11 anni.
Il nuovo trattamento chiamato CASGEVY (exagamglogene autotemcel), sviluppato dall’azienda americana Vertex Pharmaceuticals insieme a CRISPR Therapeutics, società biotech svizzera cofondata da Emmanuelle Charpentier, è indicato per l’anemia falciforme (SCD, acronimo di Sickle cell disease) e per la beta-talassemia trasfusione-dipendente (TDT, acronimo di Talassemia Trasfusione Dipendente), con l’indicazione per il trattamento di pazienti di età pari o superiore a 12 anni. Circa 15.000 persone nel Regno Unito soffrono di anemia falciforme.
L’anemia falciforme e la β-talassemia
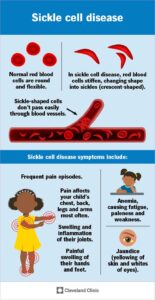
L’anemia falciforme e la β-talassemia sono malattie del sangue causate da errori nei geni che codificano l’emoglobina, la molecola che aiuta i globuli rossi a trasportare l’ossigeno in tutto il corpo.
Nell’anemia falciforme, l’emoglobina anormale rende le cellule del sangue deformi e appiccicose, causando la formazione di grumi che possono ostruire i vasi sanguigni.
Questi blocchi riducono l’apporto di ossigeno ai tessuti, il che può causare periodi di forte dolore, noti come crisi dolorose.
Per il trattamento, i pazienti affetti da anemia falciforme, devono presentare anche crisi vaso-occlusive ricorrenti, un genotipo specifico (βS/βS, βS/β+ o βS/β0) e non avere a disposizione un donatore compatibile per il trapianto di cellule staminali ematopoietiche.
bassi livelli di emoglobina
 La β-talassemia si verifica quando le mutazioni portano a bassi livelli di emoglobina nel sangue, basso numero di globuli rossi e sintomi come affaticamento, mancanza di respiro e battiti cardiaci irregolari.
La β-talassemia si verifica quando le mutazioni portano a bassi livelli di emoglobina nel sangue, basso numero di globuli rossi e sintomi come affaticamento, mancanza di respiro e battiti cardiaci irregolari.
Anche in questo caso il trattamento è destinato ai pazienti per i quali non è disponibile un donatore per il trapianto di midollo.
Casgevy prevede il prelievo delle cellule staminali dal midollo osseo, di persone con entrambe le malattie che vengono corrette in laboratorio tramite CRISPR – Cas 9 per modificare i geni che codificano l’emoglobina in quelle cellule. Lo strumento di editing genetico si basa su una molecola di RNA che guida l’enzima (nucleasi) Cas9 verso la regione corretta del DNA, che l’enzima taglia.
produzione di emoglobina fetale
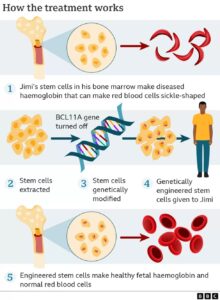
Una volta che Cas9 raggiunge il gene bersaglio di Casgevy, chiamato BCL11A, taglia entrambi i filamenti di DNA.
BCL11A di solito impedisce la produzione di una forma di emoglobina che viene prodotta solo nei feti (HbF). Interrompendo questo gene, Casgevy scatena la produzione di emoglobina fetale (HbF), che non presenta le stesse anomalie dell’emoglobina adulta nelle persone affette da anemia falciforme o β-talassemia.
Prima che le cellule geneticamente modificate vengano reinfuse nell’organismo umano, le persone devono sottoporsi a un trattamento che prepara il midollo osseo a ricevere le cellule modificate. Una volta somministrate, le cellule staminali danno origine a globuli rossi normali contenenti HbF, nel giro di poche settimane.
L’HbF, essendo in grado di trasportare l’ossigeno rimpiazza così la forma adulta di emoglobina di cui i pazienti affetti da TDT o anemia falciforme sono privi. L’aumento di HbF ha il potenziale per ridurre la necessità di trasfusioni per i pazienti con talassemia e diminuire le crisi dolorose e debilitanti in quelli con anemia falciforme.
Terapia Genica
 Nei trials, 28 su 29 pazienti con anemia falciforme non presentavano dolore intenso e 39 su 42 pazienti con beta talassemia non avevano più bisogno di trasfusioni di sangue per almeno un anno.
Nei trials, 28 su 29 pazienti con anemia falciforme non presentavano dolore intenso e 39 su 42 pazienti con beta talassemia non avevano più bisogno di trasfusioni di sangue per almeno un anno.
Il farmaco, in passato, è stato battezzato come exa-cel (exagamglogene autotemcel) o CTX001 ed è anche in attesa di approvazione anche da parte dell’Agenzia Europea per i Medicinali (EMA) e dalla Food and Drug Administration statunitense..
Essendo il primo trattamento nascente dell’editing genomico CRISPR-Cas 9 regolarmente autorizzato, è destinato a finire nei libri di storia accanto ai prodotti simbolo di altri grandi avanzamenti della biomedicina, come il primo farmaco prodotto in batteri geneticamente modificati (l’insulina ricombinante approvata nel 1982 e ribattezzata Humulin) e il primo vaccino basato sulla tecnologia dell’RNA messaggero per il Covid-19 autorizzato nel 2020.
la storia di Jimi Olaghere
Jimi Olaghere è stato uno delle prime persone a sottoporsi a questa forma di trattamento all’età di 35 anni, in maniera sperimentale, nel 2019, negli Stati Uniti. Il dolore è stato il compagno di tutta la vita di Jimi. Egli aveva convissuto dalla nascita con l’anemia falciforme.
“E’ come avere schegge di vetro che ti scorrono nelle vene o qualcuno che ti martella le articolazioni. Ti svegli la mattina con il dolore e vai a letto con il dolore. Devi sempre avere una mentalità da guerra, sapendo che i tuoi giorni saranno pieni di sfide.”
Aveva affermato. Nel 2022, in un’intervista alla BBC ha dichiarato:
“E’ stato il miglior regalo di Natale di sempre. È come rinascere. Quando guardo indietro, è come … Wow, non posso credere di aver convissuto con tutto questo!”
Bibliografia e Riferimenti:
- Wong C. (2023) “UK first to approve CRISPR treatment for diseases: what you need to know”; Nature 623: 676 – 677
- Press release: “MHRA authorises world-first gene therapy that aims to cure sickle-cell disease and transfusion-dependent β-thalassemia“
- Fergus Walsh: “Casgevy: UK approves gene-editing drug for sickle cell“, Pubblicato il 16 novembre 2023 sul sito della BBC.
- Philippidis A. (2023) ”CRISPR Therapeutics, Vertex Complete Rolling Biologics License Applications for Exa- Cel in Sickle Cell Disease, Beta Thalassemia” Hum Gen Ther 34 (9-10): 341-344.
- “Authorization of the First CRISPR/Cas9 Gene-Edited Therapy, CASGEVY™ “; November 16, 2023
- “CRISPR Therapeutics and Vertex Complete Submission of Rolling Biologics License Applications (BLAs) to the US FDA for exa-cel for the Treatment of Sickle Cell Disease and Transfusion-Dependent Beta Thalassemia” -EU and UK filings completed in 2022; submissions validated by EMA and MHRA and the review procedure has begun as of January 2023-
- Sickle cell: ‘The revolutionary gene-editing treatment that gave me new life’ – Published 20 February 2022 – [By James Gallagher, Inside Health presenter, BBC Radio 4]