Storia dell’ECMO
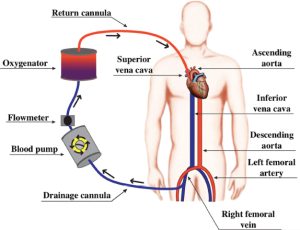
L’ECMO (ExtraCorporeal Membrane Oxygenation) è un supporto extracorporeo alle funzioni vitali (ECLS – ExtraCorporeal Life Support), cioè una tecnica di circolazione extracorporea alla quale si ricorre temporaneamente nel trattamento di pazienti affetti da insufficienza respiratoria o cardiocircolatoria che non rispondono ai trattamenti convenzionali e che vicaria, quindi, temporaneamente la funzione cardiaca e polmonare.
Il prelievo del sangue da parte della macchina si ha sempre dal versante venoso mentre la restituzione del sangue ossigenato può avvenire nel circolo venoso (ECMO veno-venoso) oppure nel circolo arterioso (ECMO Veno-Arterioso).
L’ECMO Veno-Venoso non garantisce un supporto emodinamico diretto e si utilizza per supportare la ventilazione e l’ossigenazione quando la funzionalità cardiaca sia preservata o moderatamente compromessa.
veno-venoso e veno-arterioso
I principali vantaggi dell’ECMO Veno-Venoso rispetto al Veno-Arterioso sono quello di evitare la cannulazione arteriosa che comporta rischi ischemici ed embolici e l’altro vantaggio è conservare un flusso pulsatile.
L’ ECMO veno-arterioso, invece, supporta sia gli scambi gassosi che la circolazione.
Il sistema è composto da:
• una pompa rotativa centrifuga, che si sostituisce alla funzione cardiaca.
• un ossigenatore a membrana, che arricchisce il sangue di O2 e lo decapneizza, cioè sottrae la CO2 sostituendosi, così, alla funzione ventilatoria polmonare.
• un riscaldatore, necessario per evitare perdite caloriche che avvengono durante il passaggio del sangue nel circuito.
la macchina cuore polmone del dott. Gibbon
La macchina cuore-polmone rappresenta una delle più grandi invenzioni della Medicina. Essa fu partorita dal genio e dalla determinazione del dott. John Gibbon (1903-1973) e sua moglie Mary Hopkinson.
John Gibbon ebbe l’idea nel febbraio del 1935, dopo aver passato tutta la notte seduto accanto ad una donna operata alla cistifellea, che era morta successivamente, purtroppo, per una grave complicanza, cioè per una embolia polmonare massiva.
Gibbon durante le diciassette ore in cui fu al fianco della paziente continuava a pensare che questo suo stato estremamente precario sarebbe migliorato se il sangue venoso non ossigenato fosse stato inviato in un’apparecchiatura che avesse permesso di assorbire ossigeno e cedere anidride carbonica, per poi essere di nuovo pompato nella circolazione arteriosa.
I coniugi Gibbon idearono e realizzarono una macchina che funzionava a doppio pompaggio (cuore destro e sinistro) attraverso due pompe a rullo che comprimevano a ritmo regolare dei tubi di plastica.
John Heysham Gibbon e Mary Hopkinson

Il sistema di ossigenazione che si sostituiva ai polmoni era rappresentato da una griglia in acciaio inossidabile, piatta, capace di distribuire il sangue creando un film sottile che riceveva insufflazioni di ossigeno.
Dopo molte centinaia di cani operati il primo tentativo sull’uomo fu fatto nel 1953, che risultò, però, fallimentare non per un cattivo funzionamento della macchina ma per un errore diagnostico. Dopo due mesi, esattamente il 6 maggio del 1953, fu ritentato l’utilizzo della macchina cuore-polmone su una ragazza di 18 anni affetta da difetto interatriale. L’intervento, che durò 45 minuti, questa volta ebbe un grande successo, durante il quale il cuore venne fermato per 26 minuti. Eravamo all’inizio di una nuova era della cardiochirurgia e il dott. Gibbon ebbe il gran merito di aver dato impulso al progresso in questo delicato settore. Negli anni successivi il celebre chirurgo John Kirklin realizzò numerosi interventi a cuore aperto proprio grazie alla macchina dei coniugi Gibbon.
L’ECMO NEL NEONATO

L’ECMO nel neonato, invece, si è potuto realizzare solo negli anni ’70 grazie alla evoluzione di sistemi dedicati, allo sviluppo della componentistica (ossigenatori e pompe), al miglioramento delle tecniche di impianto degli accessi vascolari nonché all’utilizzo di vene e arterie adeguate ai flussaggi richiesti.
Gli ossigenatori a membrana in silicone (Kammermeyer) soppiantarono le membrane realizzate in polietilene e teflon che ancor prima avevano sostituto l’ossigenatore a bolle eliminando lo svantaggio di avere una interfaccia diretta sangue-gas.
Le nuove membrane permettevano di ottenere la riduzione del problema dell’emolisi, la somministrazione di una minor dose di anticoagulanti e la diminuzione, per la maggior parte dei pazienti, di eventi emorragici.
UNA TECNOLOGIA SEMPRE PIù ALL’AVANGUARDIA
All’epoca la maggior parte dei dispositivi per l’ECMO al neonato era adattata da apparecchi per adulti che utilizzavano pompe a rulli che comprimevano il tubo di flusso per spingere il sangue ma nello stesso tempo determinavano emolisi. Queste pompe vennero, così, sostituite da pompe centrifughe, che sono utilizzate attualmente nella maggior parte dei centri ECMO e che presentano importanti vantaggi, rispetto ai primi modelli, come bassa emolisi, usabilità su un’ampia gamma di flussi e ridotto rischio di embolia gassosa.
L’ultimo grande problema da superare nella ricerca per eseguire con successo un bypass nel neonato era trovare un adeguato accesso vascolare. I primi ricercatori utilizzarono i vasi ombelicali, che non garantivano, però, flussi ottimali.
UNA NUOVA SPERANZA
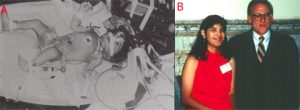
Successivamente vennero incannulati la vena giugulare interna e l’arteria carotide comune per l’ECMO VA, che consentivano un flusso sufficiente per un bypass cardiopolmonare.
La risoluzione di questi molteplici problemi ha consentito successivamente al dott. Robert H. Bartlett (nato l’8maggio del 1939), ricercatore e professore emerito di chirurgia presso la facoltà di medicina dell’Università del Michigan, di realizzare nel 1975 la prima applicazione di successo dell’ECMO in un neonato con l’insufficienza respiratoria refrattaria ad altri trattamenti.
Bartlett nel 1985, riferii alla comunità scientifica i suoi risultati di 45 casi di ECMO su pazienti neonati riportando il 56% di sopravvivenza e di questi l’80% senza conseguenze.
Riferimenti:
- Angeletti L.R. e coll. (2002), ‘La Storia della Cardiologia’, pp. 156-157
- “Extracorporeal membrane oxygenation therapy in adult patients: a narrative review of literature“, di Tarig Fadelelmoula (Department of Respiratory Care, College of Applied Sciences, Almaarefa University, Riyadh, Saudi Arabia). IJMDC. 2020; 4(3): 547-554doi: 10.24911/IJMDC.51-1576331607
- Gibbon, J.H. ‘The development of the Heart/Lung Apparatus’, American Journal of Surgery, 1978, 135, pp.608-619.
- “Prolonged Extracorporeal Oxygenation for Acute Post-Traumatic Respiratory Failure (Shock-Lung Syndrome) — Use of the Bramson Membrane Lung“, di J. Donald Hill, M.D., Thomas G. O’Brien, M.D., James J. Murray, M.D., Leon Dontigny, M.D., M. L. Bramson, A.C.G.I., J. J. Osborn, M.D., and F. Gerbode, M.D. – N Engl J Med 1972; 286:629-634
DOI: 10.1056/NEJM197203232861204 - “Extracorporeal life support in polytraumatized patients“, di Massimo Bonacchi (International Journal of Surgery – Volume 33, Part B, September 2016, Pages 213-217)
- K. Kammermeyer ‘Silicone rubber as a selective barrier’ Ind Eng Chem. 49:1685 1957
- Goldsmith JP, Karotkin EH, Keszler M., Suresh GK, (2017) ‘Assisted Ventilation of the Neonate’, Elsevier Ed.
- “Severe Pneumonia Caused by Influenza A (H1N1) Virus Successfully Managed with Extracorporeal Life Support in a Comorbid Former Preterm Infant“, di Genny Raffaeli, Giacomo Cavallaro, Lorenza Pugni, Ernesto Leva, Andrea Artoni, Simona Neri, Chiara Baracetti, Mauro Cotza, Valerio Gentilino, Leonardo Terranova, Susanna Esposito, Fabio Mosca
- https://it.wikipedia.org/wiki/ECMO
- https://en.wikipedia.org/wiki/Robert_Bartlett_(surgeon)
- “Esperanza: The First Neonatal ECMO Patient“, di Robert H Bartlett (PMID: 29084039 DOI: 10.1097/MAT.0000000000000697)
- “The History of ECMO“, di Patti Raval
articolo di Domenico Dentico