Allotrapianti e xenotrapianti: passato, presente e futuro
- Articolo del professor Sergio Barocci, Università di Genova – UNISenior
dai primi esperimenti al Tardo Medioevo
L’idea di sostituire parti del corpo malate o danneggiate ha da sempre esercitato un certo fascino sull’essere umano e sin dall’antichità ha acceso speranze, alimentando miti e leggende.
Una prima descrizione è datata intorno al VI secolo a.c. dove viene dettagliato in un testo indiano in sanscrito il Susruta Sanhita l’uso di lembi cutanei autologhi per la sostituzione di nasi mancanti.
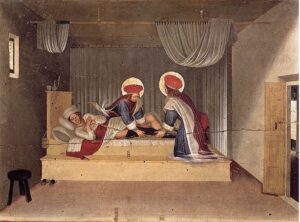
Nel mondo occidentale, invece, l’immagine di un trapianto riuscito di una intera gamba da parte dei Santi Medici del III secolo Cosma e Damiano viene raffigurata in diversi famosi dipinti.
IL RINASCIMENTO

Anche nel XVI secolo il chirurgo ed anatomista italiano Gaspare Tagliacozzi (1545 – 1599), insieme ad altri chirurghi plastici pionieri ebbe un certo successo con tali procedure. Questi metodi consentivano l’utilizzo di innesti di tessuto del paziente o di altri donatori.
Le prime testimonianze storiche di trapianti umani di tessuti e di organi sono da far risalire al XVII secolo con alcuni resoconti di xenoinnesti ossei ad opera del chirurgo olandese Job Hanzoon van Meekeren (1611 – 6dicembre 1666), che curò un soldato ferito alla testa con un pezzo di osso proveniente dal cranio di un cane, e sebbene la guarigione fosse perfetta, la Chiesa ne ordinò la rimozione.
Sempre nel XVII secolo il medico francese Jean Baptiste Denys (1643 – 1704) cominciò nel 1667 a trasfondere il sangue di animali ad alcuni pazienti (xenotrasfusione).
SETTECENTO ED OTTOCENTO

Tuttavia, questa pratica trasfusionale venne poi messa al bando dalla Francia nel 1670 a causa di controversie etiche diventando solo di sicuro affidamento nei primi anni del ‘900, grazie agli studi del fisiologo austriaco naturalizzato statunitense Karl Ernest Landsteiner (1868 – 1943).
Altri trapianti sperimentali su animali d’acqua furono effettuati, invece, nel XVIII secolo da un certo zoologo svizzero Abraham Trembley (3settembre 1710 – 12maggio 1784) ed autotrapianti di speroni di galli nei loro pettini dal chirurgo scozzese John Hunter (1728 – 1793).
Agli inizi del XIX secolo vi furono alcuni tentativi di xenoinnesti cutanei dalla pecora all’uomo.
Successivamente vennero effettuati altri tentativi con conigli, cani, gatti, rane, polli e persino con dei piccioni. Nel 1838 iniziarono, anche, le prime sperimentazioni pratiche di trapianti di cornea, utilizzando cornee di animali nell’occhio umano e in seguito, cellule animali.
IL NOVECENTO

Da questo momento si dovettero attendere ben oltre sessant’anni per assistere nel 1905 al primo trapianto riuscito di cornea nella storia della medicina da uomo a uomo da parte dell’oftalmologo austriaco Eduard Zirm ( 1863 – 1944) che trasferì la cornea di un ragazzo di undici anni, morto in un incidente, nell’occhio di un manovale accecato dalla calce viva; cornea che rimase trasparente anche dopo la guarigione.
Negli anni successivi, a partire dal XX secolo, la ricerca medica incominciò ad orientarsi verso la pratica della sostituzione degli organi principalmente con gli allotrapianti, i quali diventarono e rimasero di fatto per molti decenni, l’unico approccio accreditato dalla Comunità Scientifica.
Il riconoscimento del concetto di trapianto e i pionieri con le prime innovazioni chirurgiche nel XX Secolo

La nascita della medicina dei trapianti incominciò progressivamente ad affermarsi solo a partire dal XX secolo, intesa come sostituzione di organi dapprima in animali e poi nell’uomo.
I primi tentativi di trapianti di organi solidi, come quelli renali, iniziarono nei primi anni del ‘900, con l’intendimento di studiare le vie migliori per arrivare alle anastomosi vascolari e con l’adozione dell’acido fenico come antisettico in chirurgia propugnata dal medico britannico Joseph Lister (1827 – 1912) nel 1867.
Al biologo e chirurgo francese Alexis Carrel (1873 – 1944 ) si attribuisce, invece, il merito di aver originato sia la sutura vascolare sia il suo utilizzo nei trapianti di organi.
L’anastomosi dei vasi sanguigni

Anche se gli venne assegnato con merito il Premio Nobel per la Medicina nel 1912 per lo sviluppo di queste tecniche, in realtà Carrel non risultò il primo in questa impresa.
I primi tentativi furono fatti dal fisiologo russo Vladimirovich Eck (1849 – 1908) nel 1877 che eseguì quella che potrebbe essere definita la prima anastomosi vascolare in un cane, utilizzando suture di seta.
La stessa tecnica fu utilizzata nel 1897 dal chirurgo statunitense John Benjamin Murphy (1857 -1916) che eseguì una riparazione vascolare femorale dopo una ferita da arma da fuoco.
Nel 1896 fu, invece, la volta del chirurgo francese Mathieu Jaboulay, dove Carrel si formò, a perfezionare innovative tecniche di suturazione dei vasi sanguigni a tutto spessore in animali da esperimento, con aghi dritti e filo di seta, introdotti nel 1890 dal chirurgo austriaco Erwin Payr (17febbraio 1871 – 6aprile 1946).
NUOVE TECNICHE DI SUTURAZIONE

Carrel, adottò questo metodo solo qualche anno dopo, utilizzando una nuova tecnica di suturazione efficace e sicura avvalendosi di aghi piccoli e più sottili e materiali di sutura come fili di cotone, su consiglio del fisiologo statunitense Charles Guthrie (1880 – 1963), con il quale collaborò durante i suoi dodici mesi del 1904 trascorsi a Chicago negli U.S.A., trapiantando organi diversi negli animali, alcuni con successo (autotrapianti) e altri (xenotrapianti ) senza successo. Il risultato principale di queste sperimentazioni fu l’emergere dell’esistenza di una qualche incompatibilità biologica, nel caso dei fallimenti.
Dopo aver lasciato Chicago nel 1906 per il Rockfeller Institute di New York dove lavorò sotto l’influenza del collega statunitense James Bumgardner Murphy (4agosto 1884 – 24agosto 1950), che aveva mostrato come la trasfusione di cellule adulte della milza (in prevalenza linfociti) poteva impedire l’insorgenza di tumori nel sacco vitellino degli embrioni di pollo.
TRA L’EUROPA E L’AMERICA

Tuttavia, solo a partire dagli anni ‘50 venne riscoperta la portata del suo lavoro sui trapianti. Carrel nel 1914 ritornò in Francia dagli U.S.A. pubblicando una revisione critica di tutti gli esperimenti eseguiti negli anni precedenti.
La prima guerra mondiale interruppe la sua ricerca sui trapianti e, dopo aver trascorso il periodo del conflitto curando soldati feriti, ritornò al Rockfeller Institute non per continuare la ricerca sui trapianti ma per collaborare con l’aviatore statunitense Charles Lindbergh (1902 – 1974) sulla perfusione di organi e tessuti.
Agli inizi del ‘900 come liquido di perfusione si utilizzava una soluzione fredda di Ringer lattato (destrano, plasma, glucosio, bicarbonato), ma a partire dal 1969 entrò in uso la soluzione di Collins modificata in Eurocollins per la conservazione del rene fino a sei ore e infine nel 1988 venne approvata una nuova soluzione, la soluzione di Belzer, che che permise di allungare i tempi di preservazione degli organi più a lungo, rivoluzionando il campo di attività chirurgica.
SOLUZIONI PER TRASFUSIONI
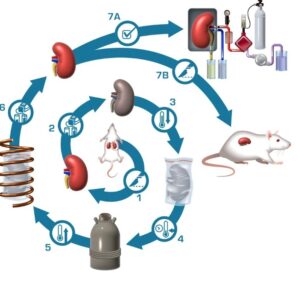
La soluzione di Belzer fu messa a punto da Folkert Oene Belzer (5ottobre 1930 – 6agosto 1995), all’Università del Wisconsin, e prese anche il nome di soluzione UW. Il suo scopo era quello di minimizzare gli effetti del rigonfiamento cellulare indotti dall’ipotermia, evitare l’acidosi intracellulre, impedire l’espansione dello spazio interstiziale, impedire i danni da radicali liberi (soprattutto durante la riperfusione) e fornire i substrati per la rigenerazione dei fosfati ad alta energia durante la riperfusione.
Alla fine degli anni ’90 fu proposta la soluzione di Celsior, inizialmente per la conservazione del cuore ma poi anche per altri organi da trapianto come rene, fegato e pancreas. La formulazione della soluzione di Celsior era stata progettata per soddisfare due obiettivi principali: (1) combinare i principi generali della conservazione ipotermica degli organi con quelli specifici per il miocardio e (2) offrire la possibilità di essere utilizzata non solo come mezzo di conservazione ma anche come fluido di perfusione durante l’arresto cardiaco iniziale del donatore, il reimpianto dell’innesto post-conservazione e la riperfusione precoce.
TECNICHE INNOVATIVE

Nel 2023 è stata sperimentata, per ora solo sugli animali (ratti), un’innovativa tecnica da parte dell’Università del Minnesota, dove i reni espiantati vengono congelati in modo ultrarapido tramite azoto liquido a – 150°C (in questo caso consiste la vetrificazione) e poi riportati alla piena funzionalità con un sistema particolare di nanoriscaldamento. Questi reni vetrificati possono essere conservati fino a 100 giorni e se questa tecnica potrà essere poi applicata anche agli esseri umani, consentirà di pianificare meglio i trapianti.
Lo sviluppo della tecnica chirurgica di sutura per mezzo di Carrel, in grado di permettere più facilmente il collegamento dei vasi sanguigni, risultò in seguito una tappa fondamentale per sperimentazioni future di trapianti d’organo (allotrapianti), insieme alla scoperta dei gruppi sanguigni, per comprendere l’origine immunologica di questa “bio incompatibilità” con l’identificazione di alcuni componenti della reazione immunitaria (in particolare i linfociti).
SISTEMA IMMUNITARIO E TRAPIANTI

Agli inizi degli anni ‘20, il fatto più sorprendente fu la rapida acquisizione di maggiori informazioni su come poteva essere modificato il Sistema Immunitario. James B. Murphy fu, certamente, in questo periodo una figura di spicco per la la rimozione dei linfociti o per la loro inattivazione.
La modificazione di questa bio-incompatibilità rapidamente individuata con radiazioni γ per i suoi effetti nella soppressione del midollo osseo e del sistema linfoide, con il benzolo che bloccava la formazione di anticorpi, con la mostarda azotata e con l’iprite, utilizzate nella prima guerra mondiale che sviluppavano entrambe depressione del midollo osseo e leucopenia, divenne possibile, trapiantare organi come il rene, sopprimendo la reazione immunitaria. In realtà, questa possibilità venne ritardata di altri trenta anni per alcuni scandali su pratiche dubbie come gli xenotrapianti di testicoli umani con testicoli di scimmia.
REAZIONI TISSUTALI

Questo campo fu guidato dal chirurgo russo Serge Voronoff (1866 – 1951) con l’obiettivo di ripristinare la potenza sessuale ma anche per un ringiovanimento generale.
Tuttavia, a tenere ancora accesa la fiamma che le reazioni tissutali agli innesti estranei fossero una tappa fondamentale con l’implicazione di infiltrati cellulari, contribuirono rispettivamente un patologo tedesco – statunitense Leo Loeb (1869 -1959) all’Università St. Louis su omoinnesti cutanei in ratti ed un fisiologo statunitense, Frank C. Mann (1887 – 1962), alla Mayo Clinic di Rochester su omoinnesti renali e cardiaci canini, ma senza risultati apprezzabili.
I trapianti di rene tecnicamente riusciti furono eseguiti per la prima volta non da Carrel ma dal chirurgo austriaco Emerich Ullmann (1861 – 1937), pioniere del trapianto renale, ricordato come colui che diede l’avvio all’era della trapiantologia, stimolando la chirurgia vascolare e lo sviluppo dell’immunologia dei trapianti.
Emerich Ullmann

Nel 1902 Ullmann sperimentò a Vienna alcuni autotrapianti, allotrapianti e xenotrapianti nei cani e nelle capre, utilizzando la tecnica di suturazione di Payr, con lo spostamento del rene dalla sua sede naturale in altra sede.
Nello stesso anno egli eseguì, anche, senza successo uno xenotrapianto renale da maiale su una donna allo stadio terminale di insufficienza renale. Sempre a Vienna nel 1902 in un’altra clinica, un altro chirurgo austriaco Alfred von Decastello Richtwehr (1872 – 1960) eseguì analoghi trapianti cane – cane.
Nel 1906 ci furono da parte del chirurgo francese Mathieu Jaboulay altri due tentativi di xenotrapianti su due uomini diversi, entrambi con uremia terminale, cercando come organo donatore un maiale per uno e per l’altro, invece, come organo donatore una capra. Il rene di maiale fu trapiantato nel braccio usando l’arteria brachiale nel primo paziente, funzionando con la produzione di una quantità normale di urina fino a coagulazione dell’arteria al terzo giorno.
XENOTRAPIANTI
Il rene di capra, diversamente da quello di maiale fu trapiantato nella coscia del secondo paziente, anche questo senza successo iniziale.
Anche a Berlino seguirono ulteriori sperimentazioni di trapianti renali condotti dal chirurgo tedesco Ernst Unger (1875 – 1938). Egli dopo aver eseguito per la prima volta più di 100 trapianti renali su animali. Eseguì nel 1909 due xenotrapianti renali nell’uomo senza successo, utilizzando come donatori primati non umani, pur avendo i reni funzionato per non più di pochi giorni.
I lavori iniziali sui trapianti d’organo portarono alla ribalta l’idea di una incompatibilità biologica tra le specie, in grado di precludere il successo dei trapianti.
Il ruolo degli immunologi e la barriera dei trapianti

Pertanto, la scoperta di vari componenti della reazione immunitaria, accelerò notevolmente nei primi anni ‘20 del XX secolo dopo che i fagociti come agenti difensivi furono descritti dal biologo ucraino Ilya Metchnikoff (1845 – 1916) nel 1880 e poi gli anticorpi con l’immunologo tedesco Paul Ehrlich (1854 – 1915), Premio Nobel per la Medicina nel 1908, tra gli anni 1890 e 1900.
L’ALESSINA

Inoltre, il biologo austriaco nel 1902 Karl Landsteiner (1868 – 1943) descrisse i gruppi sanguigni umani ABO, mentre il medico tedesco Hans Buchner (1850 – 1902) e il batteriologo belga Jules Bordet (1870 – 1961) lavorando a Parigi individuarono l’alessina, una sostanza non specifica e instabile al calore a 56°C che in seguito fu chiamata da Ehrlich “complemento”.
Tutti questi fattori, si sono rivelati importanti come aspetti per il riconoscimento e l’eliminazione di agenti o antigeni estranei compresi quelli nei trapianti.
Così, solo negli anni ‘20 del XX secolo emerse l’idea che gli innesti di tessuti e i trapianti di organi venissero distrutti attraverso meccanismi nella difesa contro organismi estranei anche se i dettagli rimasero ancora scarsi.
TRAPIANTI ED IMMUNITà

Nel 1912 il medico tedesco Georg Schöne (1875 – 1960) che si occupò di trapianti cutanei e di tumori, nel suo libro dal titolo “Heteroplastische und Homoplastische Transplantation“ formulò delle osservazioni che lo condussero al primo uso del termine “tranplantations immunitat”, descrivendo la perdita accelerata di secondi innesti tra gli stessi individui, così annoverate:
1. un trapianto in una specie estranea fallisce inevitabilmente; 2. un trapianto tra membri non imparentati della stessa specie, in genere, fallisce; 3. gli autotrapianti hanno quasi sempre successo; 4. in un trapianto allogenico esiste dapprima un periodo di attecchimento e poi un rigetto tardivo; 5. un rigetto accelerato di un secondo innesto si verifica in un ricevente che in precedenza aveva rigettato un innesto dallo stesso donatore o di un primo innesto in un ricevente che era stato in precedenza sensibilizzato con materiale proveniente dal tumore del donatore; 6. quanto più stretto è il legame o la consanguineità tra donatore e ricevente, tanto più grande è la probabilità di successo del trapianto.
INNESTI

Anche suo contemporaneo il chirurgo tedesco Erich Lexer, pioniere della chirurgia plastica e ricostruttiva, ebbe la sua stessa idea descrivendo una reazione simile che portava alla distruzione di tutti gli omoinnesti.
A Londra, invece, un altro brillante allievo di P. Ehrlich, l’oncologo inglese Ernest Francis Brashford (1873 – 23agosto 1923 ), che aprì la strada all’approccio biologico allo studio del cancro, confermò le osservazioni di Schone sugli innesti accelerati.
Gli studi effettuati in seguito, rivelarono l’esistenza di geni multipli di istocompatibilità con pattern di ereditarietà mendeliana senza però individuarne i loci genetici, poiché l’unico parametro valutato fu la crescita del tumore trapiantato che nascondeva ogni altra singolarità.
GENETICA ED IMMUNITà

George Snell (1903 – 1996), biologo statunitense, nel 1935, incoraggiato dal genetista Clarence Cook Little, inventò i topi congenici cioè ceppi murini che possiedono lo stesso background genetico ma che differiscono solo in un locus, scoprendo che uno di questi loci era strettamente correlato al rigetto dei tumori trapiantati e che chiamò H, da istocompatibilità.
Nel 1937 l’immunologo e genetista britannico Peter Alfred Gorer (14aprile 1907 – 1961) scoprì un anticorpo emoagglutinante associato al rigetto del trapianto di tumore. Stabilì, molto presto, che tale risposta anticorpale non era una caratteristica generale del rigetto del trapianto e che l’antigene compromesso (denominato antigene II) era codificato da un gene situato nel locus H individuato da G. Snell. Da questo momento nacque il termine H-2 che successivamente definì un intero complesso di geni di istocompatibilità murina.
PETER MEDAWAR

Negli anni ‘40 quello che fu sorprendente è l’aver dimenticato i progressi ottenuti nei primi decenni del XX secolo, mentre accettati come nuove scoperte furono i lavori del biologo britannico Peter Medawar (1915 -1987), Premio Nobel per la Medicina nel 1960, sul rigetto dei trapianti di tessuti normali da parte di ospiti allogenici.
Egli, nel 1946 come prova che la reazione dell’allotrapianto era di natura immunologica descrisse tre caratteristiche del rigetto: a) risposta accelerata ai secondi innesti cutanei ; b) specificità e natura della sensibilizzazione. Queste caratteristiche dimostrarono, inoltre, che i leucociti possedevano gli stessi antigeni di trapianto della cute e che la sensibilizzazione era ugualmente efficace con l’uno o con l’altro tipo di cellule.
Nel 1954 l’immunologo inglese Avrion Mitchinson fornì la prova sperimentale che la reazione dell’allotrapianto non era mediata da anticorpi, dimostrando nel suo esperimento di trasferimento adottivo che lo stato di sensibilizzazione del ricevente che rigettava un trapianto di tumore poteva essere trasferito ad un nuovo ricevente con i linfociti e non con il siero.
RIGETTO

La prova finale della mobilità dei linfociti arrivò nel 1959 quando l’immunologo britannico James Gowans (17maggio 1924 – 1aprile 2020) dimostrò che i linfociti circolavano dal sangue alla linfa.
La scoperta del Complesso Maggior di Istocompatibilità o MHC

Lo straordinario polimorfismo individuato nel locus H-2 contribuì ad accrescere ulteriore confusione iniziale e a causa della sua complessità venne considerato di scarso interesse da parte di altri ricercatori. Tuttavia, non mancarono gli approfondimenti in questo campo poiché diversi erano i motivi per rivalutarne la sua importanza:
1) La scoperta che altri mammiferi possedevano geni dell’ MHC omologhi al topo H-2. Nell’uomo questi geni vennero chiamati HLA o Antigeni leucocitari umani.
2) La relazione dell’H-2 con le caratteristiche della sua suscettibilità e resistenza ad alcuni virus e con il controllo genetico della risposta immunitaria ad alcuni antigeni.
La scoperta che antigeni simili all’H-2 murino potevano essere controllati da diversi loci del complesso condusse alla reinterpretazione dei dati, facilitando il sincronismo tra la sierologia e la genetica in un nuovo modello del sistema a due loci, contemplando l’esistenza di soli due geni o gruppi di geni di istocompatibilità H2-K e H-2D.
DAUSSET

Nell’uomo, la storia del Maggiore Complesso di Istocompatibilità MHC si fa risalire agli anni ‘50. Tra il 1953 e il 1954 l’immunologo francese Jean Dausset ( 1916 – 2009), premio Nobel per la Medicina nel 1980, studiando pazienti leucopenici bisognosi di numerose trasfusioni di sangue, scoprì che il deficit cellulare di questi pazienti derivava dall’azione di anticorpi agglutinanti che attaccavano selettivamente i leucociti estranei attraverso la trasfusione.
Egli ipotizzò correttamente che tali reazioni anticorpali erano stimolate da alcuni antigeni, situati sulla superficie di globuli bianchi estranei, chiamati successivamente antigeni leucocitari umani o antigeni HLA, rivelatisi estremamente utili nel determinare se i tessuti di una persona possono essere trapiantati con successo in un altro individuo (processo, chiamato tipizzazione tessutale).
SELF E NON SELF

J. Dausset, inoltre, dimostrò che questi antigeni erano programmati da un complesso genico altamente variabile, che si rivelò analogo al complesso H-2 nel topo scoperto da G. Snell, complessi entrambi visti come un Sistema Maggiore di Istocompatibilità o MHC la cui funzione doveva essere quella di aiutare il sistema immunitario di tutti i vertebrati a distinguere il self dal non self.
Tra il 1952 e il 1957 egli dedicò gran parte del suo lavoro allo sviluppo di tecniche di leuco e trombo – agglutinazione e di ulteriori modi per confermare la presenza di alcuni anticorpi, descrivendo nel 1958 il primo antigene leucocitario, chiamandolo MAC, un acronimo fatto dalle iniziali dei primi tre donatori, in seguito conosciuto come HLA-A2. Questa scoperta venne pubblicata sulla rivista scientifica Acta Haematologica in cui si sottolineava la possibile importanza di questi gruppi nel trapianto di organi e tessuti.
LEUCO-AGGLUTINAZIONE

Nel 1958 l’immunologo olandese Jon van Rood (1926 – 2017) mise a punto un metodo di leuco-agglutinazione molto più affidabile e preciso e, con l’utilizzo di uno dei primi computer, riuscì ad analizzare con maggior facilità un panel di sieri più ampio. Grazie a questi mezzi, egli riconobbe due antigeni, chiamandoli 4a e 4b (poiché li riteneva alleli dello stesso locus), oggi noti come specificità Bw4 e Bw6.
Ulteriori antigeni vennero identificati , poco dopo, anche dalla biologa molecolare Rose Payne (1909 -1999), in collaborazione con il genetista inglese Walter Bodmer (1936 – ), denominati LA1 e LA2.
Sia il sistema biallelico 4a/4b che il sistema LA, strettamente collegati, hanno rappresentato la base dell’MHC umano che in seguito assumerà la denominazione di sistema genetico HLA con i loci HLA-A e HLA-B.
test di tipizzazione tissutale

Nel 1964 l’immunogenetista statunitense Paul Terasaki (1929 – 2016) introdusse un test di tipizzazione tissutale per donatori e riceventi di trapianti di organi definito test di microlinfocitotossicità complemento dipendente perché impiegava solo 1 μl di antisieri utilizzati per gli antigeni HLA sui linfociti, diventando ben presto il test standard del NIH (National Institutes of Health) per i trapianti.
Un altro test sviluppato da P. Terasaki fu quello del cross – match in grado di identificare anticorpi anti – HLA specifici nel siero di potenziali riceventi prima del trapianto renale contro gli antigeni HLA del donatore per evitare il rigetto iperacuto.
Con l’espansione degli antigeni HLA, negli anni ‘60 diventò determinante valutare la compatibilità dei trapianti di organi sia solidi che di midollo osseo.
compatibilità dei trapianti di organi sia solidi che di midollo osseo

Infatti, si assistette ad una esplosione di interesse per queste molecole glicoproteiche, poiché si incominciò a comprendere non solo la loro enorme importanza nel trapianto clinico ma anche nei geni che li codificano, situati sul braccio corto del cromosoma 6, la cui funzione principale è di controllare l’espressione degli antigeni della superficie cellulare, in quanto principali determinanti delle risposte immunitarie umane e della suscettibilità a una vasta gamma di malattie.
Man mano che si rendevano disponibili più antisieri, dall’iniziale complesso HLA a due loci (HLA-A e HLA -B) se ne determinarono altri perché la disponibilità di più sieri provenienti da donne multipare e politrasfusi, permetteva l’aumento di più specificità antigeniche, portando alla postulazione di ulteriori e diverse serie alleliche in più loci (HLA – C , HLA- DR, HLA- DQ, HLA – DP).
SPECIFICITà ANTIGENICHE

Queste specificità antigeniche in base alle loro proprietà biochimiche, strutturali e di distribuzione cellulare, vennero, quindi, suddivise in Antigeni di classe I (codificati dai geni HLA – A, HLA- B, HLA- C), in Antigeni di classe II (codificati dai geni HLA-DR, HLA-DQ, HLA-DP) e di classe III (codificati dai geni del sistema complementare C2 e C4 e Fattore B).
Inizialmente il loro polimorfismo fu studiato tramite la tipizzazione sierologica e poi da test molecolari; a partire dal primo decennio del XXI secolo, dopo il Progetto Genoma Umano, invece, dal sequenziamento di nuova generazione o NGS.
La scoperta del sistema genetico HLA nell’uomo è un risultato di fondamentale importanza per la caratterizzazione delle proprietà tissutali della coppia donatore/ricevente ai fini di una migliore sopravvivenza del trapianto ma anche di identificare le caratteristiche del rigetto, di riconoscere la GVHD (graft versus host disease) nei trapianti di cellule staminali e di tentare di indurre una tolleranza verso l’organo trapiantato riducendo l’intensità della reazione immunologica.
IL TRAPIANTO DI MIDOLLO OSSEO

Verso la fine degli anni ‘50 venne sviluppato il trapianto di midollo osseo, dove si dimostrò come l’infusione di cellule midollari fosse in grado di salvare topi e cavie irradiati in maniera letale.
Nel 1957 il chirurgo statunitense Edward Donnall Thomas (1920 – 2012), al Bassett Medical Center di Cooperstown, New York, raccogliendo alcuni dati pubblicati in precedenza, perfezionò questo approccio, dapprima nei cani e poi, negli anni’70, in giovani affetti da leucemia avanzata al Fred Hutchinson Cancer Research Center di Seattle, mettendo in evidenza come le cellule staminali midollari infuse per via endovenosa fossero in grado di ripopolare il midollo e produrre nuove cellule sane. Grazie a questi studi nel 1990 fu insignito del Premio Nobel per la Medicina insieme a J. Murray.
PROGRESSI NEI TRAPIANTI
Oggi, gli interventi di trapianto di midollo osseo o di cellule staminali ematopoietiche sia autologhe che allogiche vengono praticate in maniera efficace, rappresentando una terapia consolidata per il trattamento di alcune patologie ematologiche, autoimmuni e genetiche con la compatibilità di importanza cruciale nella selezione dei donatori correlati e non.
Dopo che verso la fine degli anni ‘60 venne effettuata la conservazione del rene da donatore con Eurocollins, divenne pratica la condivisione degli organi tra i Centri Trapianto. Agli inizi, la condivisione era locale e informale.
CONDIVISIONE DI ORGANI

Nel 1967 Paul Terasaki fondò il primo Organ Sharing a Los Angeles e nel 1968 seguì la Boston Interhospital Organ Bank. Emerse, poi, la percezione che il controllo locale consentiva iniquità nell’assegnazione degli organi del donatore, maturando la preoccupazione che gli organi statunitensi fossero inviati all’estero o trapiantati a cittadini esteri. Pertanto, la necessità di una formalizzazione della distribuzione degli organi dei donatori a livello nazionale condusse all’approvazione del National Transplant Act nel 1984. La Southeastern Organ Procurement Foundation o SEOPF, fondata nel 1969 e composta da dodici ospedali di città diverse, servì da modello per l’entità nazionale risultante per controllare l’assegnazione e il posizionamento degli organi ma anche per monitorare le prestazioni dei Centri di Trapianto e delle Organizzazioni di approvvigionamento di organi e per raccogliere dati e controllo della qualità dei trapianti, la United Network for Organ Sharing o UNOS.
consolidamento dei trapianti
Negli anni ‘70 ci furono ulteriori importanti risultati per il consolidamento dei trapianti:
1. si scoprì ad esempio che le trasfusioni di sangue piuttosto che diminuire la possibilità di sopravvivenza dell’allotrapianto di rene, potevano migliorare la situazione. Questa osservazione portò alla programmazione di protocolli di trasfusione deliberate prima del trapianto, strategia che venne però abbandonata quando si incominciò ad utilizzare la ciclosporina oscurando i benefici delle trasfusioni;
2. l’origine di molte Società di trapianti nazionali e internazionali, di riviste scientifiche trapiantologiche e di Registri che assicuravano una rapida diffusione dei risultati clinici ottenuti.
Un risveglio dei trapianti negli anni ‘30 e ‘40

Il successivo evento importante durante gli anni ‘30 e ‘40 fu una serie di trapianti umani eseguiti dal chirurgo ucraino Yuri Voronoj (1895 – 1961).
A Kherson, nell’aprile del 1933, egli effettuò il primo trapianto di rene umano da cadavere (una nuova fonte di potenziali organi da utilizzare per trapianto) collocandolo nella coscia di una donna affetta da insufficienza renale acuta da avvelenamento da cloruro di mercurio. La paziente sopravvisse 48 ore. Y. Voronoj eseguì altri cinque trapianti di rene ma nessuno di questi ebbe successo tra il 1933 e il 1939 . Pubblicata in russo, questa sua esperienza trapiantologica rimase sconosciuta in Occidente fino al 1950.
Il meccanismo del rigetto
Nel Regno Unito il secondo conflitto mondiale alimentò una rinascita di interesse per l’innesto cutaneo dove emerse che il rigetto era mediato non dagli anticorpi ma dai linfociti da parte del chirurgo scozzese Thomas Gibson (24novembre 1915 – 13febbraio 1993) e di Peter Medawar che attribuì allo stesso Gibson il merito della loro scoperta del “fenomeno del second set” precedentemente descritto negli animali da altri tra cui Georg Schone nel 1912 e nell’uomo dal chirurgo statunitense Emile F. Holman (1890 – 1977).
Il fenomeno della tolleranza immunologica e la GVHD

Come gli studiosi precedenti, T. Gibson e P. Medawar si resero conto che questo fenomeno identificava il rigetto come evento immunologico.
Al termine della guerra, P. Medawar condusse a Oxford studi approfonditi sugli omoinnesti o alloinnesti cutanei nei conigli, caratterizzando i tempi, la morfologia istologica e la natura immunologica del rigetto. Non essendo a conoscenza del lavoro di James B. Murphy sul sistema linfoide, 20 anni prima, e disconoscendo anche le scoperte simili sul rigetto degli omoinnesti cutanei nei ratti con il coinvolgimento del linfocita del patologo tedesco – statunitense Leo Loeb (1869 -1959) nel 1930, rimase convinto per un altro decennio che gli innesti fallivano a causa dell’immunità umorale piuttosto che cellulare.
STUDIANDO I FREEMARTIN

Frustato dal fatto di non rilevare alcun anticorpo, distolse la sua attenzione dal rigetto del trapianto e tra la fine degli anni ‘40 e gli inizi degli anni ‘50 insieme al suo studente Rupert Everett Billingham e all’immunologo britannico Leslie Baruch Brent, iniziò a studiare il fenomeno della tolleranza, affascinato dagli studi sui freemartin (termine usato per la femmina sterile di una coppia di gemelli bovini di sesso diverso) di anni prima da parte del chirurgo britannico John Hunter (1728 -1793) nel 1779, dell’embriologo statunitense Frank R. Lillie (27giugno 1870 – 5novembre 1947) nel 1916 e dell’immunologo statunitense Ray D. Owen (1915 – 2014).
MEDAWAR E COLLEGHI

Il gruppo di lavoro di Medawar scoprì nei gemelli due tipi di globuli rossi insoliti “misti” nel 1945, e cercò di indurre il chimerismo e l’accettazione degli omotrapianti o allotrapianti nei topi, inoculando feti intrauterini con cellule di milza del ceppo del donatore.
Essi cambiarono cavie, passando ad esperimenti sui topi dimostrando che, l’inoculazione in feti con cellule viventi di un futuro donatore, rendeva i feti tolleranti agli omotrapianti, effettuati successivamente con organi prelevati dagli stessi donatori.
In poche parole, trapiantando su un topo ad esempio di ceppo A un numero adeguato di cellule spleniche di topo ad esempio di ceppo B, si poteva osservare dopo qualche settimana che, il topo di ceppo A tratteneva indefinitivamente il trapianto cutaneo del topo B, che sarebbe stato altrimenti rigettato. I loro risultati furono pubblicati in un breve articolo sulla rivista Nature.
il concetto di tolleranza acquisita

Nacque così il concetto di tolleranza acquisita attivamente già intravisto teoricamente dall’immunologo australiano Frank Macfarlane Burnet (1899 – 1985). Nel 1966, Medawar per questi studi ricevette il Premio Nobel per la Medicina insieme a Burnet.
Nel 1957, P. Medawar, R. Billingham e L. Brent durante i loro esperimenti per indurre tolleranza, individuarono, inoltre, un altro fenomeno immunologico, la malattia del trapianto contro l’ospite o GVHD (Graft-versus-host disease), ma la pubblicazione di tale scoperta venne ritardata sino al 1959 a causa del lungo anno sabbatico di Brent con Owen.
malattia del trapianto verso l’ospite

Anche il medico danese Morten Simonsen ( 1921 – 2002) a Copenaghen nel 1957 descriveva e pubblicava indipendentemente il fenomeno della GVHD (malattia del trapianto verso l’ospite) nei polli che aveva iniettato con cellule linfoidi allogeniche. Per causare la GVHD i linfociti dovevano essere mobili e ciò ha rappresentato una delle scoperte che hanno indotto P. Medawar ad accettare tardivamente l’importanza dell’immunità cellulare, di cui è diventato in seguito il principale sostenitore.
Un’altra prova ancora più eclatante venne fornita dall’immunologo britannico Avrion Mitchinson (1928 – 2022); che l’immunità agli innesti tumorali veniva trasferita dalle cellule e non dagli anticorpi.
STUDI SUCCESSIVI

Ma la prova finale della mobilità linfocitaria si ebbe dall’immunologo britannico James Gowans il quale dimostrò che i linfociti ricircolavano dal sangue alla linfa e viceversa, nel 1957.
Nel frattempo il chirurgo britannico William James Dempster (15marzo 1918 – 27luglio 2008), al St Mary’s Hospital di Londra scopriva l’irradiazione come strumento per modificare il fenomeno del rigetto nei cani.
Ci si accorse, così, che il problema degli omotrapianti o allotrapianti poteva essere risolvibile e queste scoperte incoraggiarono gli studi successivi.
Immunosoppressione

Le radiazioni, pertanto, risultarono essere il primo approccio immunosoppressivo ma con una limitazione della dose di circa 400 – 450 rads per una irradiazione sicura allo scopo di consentire l’infusione del midollo osseo.
Più tardi, nel 1959 venne però sostituita dall’immunosoppressione chimica sebbene solo occasionalmente nei trapianti.
Nel 1953 la farmacologa statunitense Gertrude B. Elion (1918 – 1999) insignita nel 1988 del Premio Nobel per la Medicina mentre lavorava al Burroughs Wellcome Fund, una organizzazione statunitense di ricerca nella Carolina del Nord, sintetizzò degli antimetaboliti purinici, il primo dei quali fu la 6-mercapto purina o 6–MP mirata per il trattamento dei tumori e il suo derivato l’azatioprina prodotto insieme al medico statunitense George H. Hitchings (1905 – 1998).
IMMUNOSOPPRESSIONE

Tuttavia, occorse del tempo, perché emergesse il concetto di trattamento a lungo termine per indurre a mantenere quella che in seguito sarà chiamata immunosoppressione.
Nel 1957 l’ematologo statunitense William Dameshek (1900 -1969) dimostrò la soppressione della formazione degli anticorpi nei conigli con 6-MP e il prolungamento della sopravvivenza nel 1959 degli allotrapianti cutanei nei conigli.
A partire dagli anni ‘60 la Comunità Scientifica iniziò a sperimentare la possibilità di utilizzare i farmaci immunosoppressori in alternativa all’irradiazione total body.
Nel Regno Unito, a Londra, il chirurgo inglese Roy Calne (1930 – 2024), dopo aver tentato senza successo l’irradiazione, scoprì che la 6-MP prolungava la funzionalità renale negli allotrapianti di cani, ottenendo un certo successo. Egli trattò anche tre riceventi di rene umano ma tutti morirono senza dimostrare alcuna funzionalità del trapianto.
CALNE E STARZL
 Successivamente, lo stesso R. Calne, iniziò a lavorare con un derivato della 6-MP, l’azatioprina dimostrando che il rigetto dei trapianti poteva essere ritardato con questo farmaco, stimolando così il team trapiantologico del Peter Brent Brigham di Boston ad adottarlo nei riceventi di rene umani.
Successivamente, lo stesso R. Calne, iniziò a lavorare con un derivato della 6-MP, l’azatioprina dimostrando che il rigetto dei trapianti poteva essere ritardato con questo farmaco, stimolando così il team trapiantologico del Peter Brent Brigham di Boston ad adottarlo nei riceventi di rene umani.
Nel 1963 ad una Conferenza tenutasi a Washington del National Research Council, la speranza che i sopraindicati farmaci potessero essere più efficaci dell’irradiazione sembrò svanire ed incominciò a sollevarsi il dubbio sui partecipanti, alcuni dei quali iniziarono a pensare che forse non era giusto continuare gli esperimenti sui trapianti.
Su questa ventata di tristezza risollevò l’atmosfera il chirurgo statunitense Thomas Starzl (1926 -2017). Egli descrisse il suo protocollo immunosoppressivo che comprendeva prednisone, un altro farmaco immunosoppressivo utilizzato insieme a dosi moderate di azatioprina che consentiva una sopravvivenza del trapianto renale del 70 %, mettendo il trapianto sulla strada del successo.
UNA NUOVA PROSPETTIVA
 L’impatto dei risultati ottenuti da T. Starzl cambiò radicalmente le prospettive dei trapianti. Il suo protocollo immunosoppressivo fu talmente rivoluzionario che nel giro di un anno, i Centri di Trapianto renale negli U.S.A. da tre operativi, ne diventarono operativi, una cinquantina.
L’impatto dei risultati ottenuti da T. Starzl cambiò radicalmente le prospettive dei trapianti. Il suo protocollo immunosoppressivo fu talmente rivoluzionario che nel giro di un anno, i Centri di Trapianto renale negli U.S.A. da tre operativi, ne diventarono operativi, una cinquantina.
Nei decenni successivi dal 1963 al 1980 ci fu un consolidamento dell’attività trapiantologica non solo renale ma anche di altri organi solidi e in questo periodo oltre lo sviluppo da parte del chirurgo inglese Michael Woodruff del siero antilinfocitario o ALG, molto efficace nel trapianto cardiaco in Europa, in particolare, per la terapia di induzione, ci furono altri sviluppi importanti.
sviluppi importanti

Ci furono altri sviluppi importanti come: a) la realizzazione di nuovi farmaci immunosoppressivi come la ciclosporina e il tacrolimus, b) la realizzazione di importanti innovazioni necessarie per la maturazione del trapianti in termini di servizio clinico come la disponibilità del trattamento dialitico, lo screening anticorpale o PRA% con il test del cross-match per evitare il rigetto iperacuto, l’importanza della tipizzazione HLA per l’istocompatibilità tissutale, l’accettazione della morte cerebrale per il prelievo di organi per trapianto e successivamente a cuore battente, la conservazione degli organi, il trasporto e l’organ sharing e l’accumulo di esperienza nella gestione dei pazienti con la riduzione delle infezioni, dei tumori e dei decessi, evitando una eccessiva immunosoppressione.
La ciclosporina, rappresentò il quel periodo di tempo, il farmaco immunosoppressivo d’elezione per trattare il rigetto d’organo, sostituito successivamente dal tacrolimus.
CICLOSPORINA E TACROLIMUS

Negli anni ‘40 diversi trapianti di rene umani vennero eseguiti in circostanze irregolari all’Ospedale Brigham tutti seguiti da insuccessi: si trattava del posizionamento dei reni provenienti da donatori cadavere sul braccio (Ernest Landsteiner e Charles Hufnagel) o sulla coscia (David Hume) dei riceventi, in quanto in quel tempo non era ancora disponibile la dialisi.
La causa di questi fallimenti risiedeva ancora nella mancata comprensione del rigetto anche se si era a conoscenza che il rigetto non si verificava nei gemelli, riducendo di molto l’applicazione della tecnica trapiantologica. Infatti, non tutti i pazienti con insufficienza renale cronica avevano un fratello gemello con un rene da offrire e qualora ci fosse stato c’era da superare il problema dell’intervento ed eventualmente quello dell’espianto in una persona sana.
DIALISI e reni

Successivamente, lo sviluppo del trapianto renale andò di pari passo con l’evoluzione delle apparecchiature di dialisi i cui prototipi funzionanti furono approntati dal nefrologo svedese Nils Alwall (1904 – 1986) e dal medico olandese Willem J. Kolff (1911 – 2009).
In quegli anni vennero anche eseguiti trapianti sperimentali di rene nei cani dove fu nuovamente osservato il fenomeno del “second set” ma senza che emergessero nuove intuizioni, nonostante diversi tentativi di prolungare la loro sopravvivenza.
Nonostante gli insuccessi sia nell’uomo che negli animali, i chirurghi incominciarono ad ignorare il pessimismo nutrito dagli immunologi sul fatto che gli allotrapianti non potevano sopravvivere all’attacco immunitario e iniziarono comunque ad eseguire trapianti renali umani e ad utilizzare agenti in grado di modificare una reazione immunitaria al trapianto come l’irradiazione, il benzolo o farmaci correlati alla mostarda azotata.
LA SPERANZA DEI CHIRURGHI

Essi speravano che alcuni trapianti avrebbero avuto un certo successo. Questa flebile speranza fu riaccesa nel 1950 dall’urologo statunitense Richard Lawler che eseguì a Chicago un trapianto di rene da cadavere in una donna di 44 anni con malattia renale policistica avanzata. Il rene funzionò per circa 50 giorni e poi fu successivamente rimosso. All’interno della professione medica questo tentativo venne ampiamente criticato ma l’impatto fu sostanzialmente positivo da incoraggiare altri chirurghi.
Poichè negli anni ‘50 non esistevano, ancora, metodi per bloccare il rigetto degli organi trapiantati, si riconobbe che il loro successo fosse alquanto remoto. Tuttavia, anche con la mancanza di un trattamento dialitico per l’insufficienza renale cronica, la continuazione degli esperimenti andò ugualmente avanti.
TENTATIVI FRANCESI

Infatti, gli unici trapianti di successo in quegli anni furono gli innesti cutanei ma seguirono anche alcuni trapianti renali da donatori viventi, dal momento che questi erano solo quelli che potevano sopravvivere.
Nel 1951 fu la volta dell’Ospedale Necker di Parigi ad effettuare trapianti renali da parte di Charles Dubost e Marceau Servelle (26aprile 1912 – 25ottobre 2002) con reni provenienti da donatori di criminali condannati appena ghigliottinati, posizionati retroperitonealmente nei riceventi nella fossa iliaca e vascolarizzati con i vasi iliaci con l’uretere anastomizzato alla vescica: una tecnica chirurgica ideata dal chirurgo francese Renè Kuss (1913 – 2006) che eseguì nello stesso anno all’Ospedale Cochin di Parigi sei trapianti di rene da cadavere.
Nessuno di questi funzionò se non per qualche giorno o settimane con decesso dei riceventi.
TRAPIANTI ETEROTOPICI
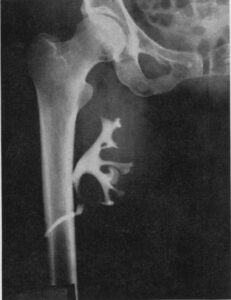
Nel frattempo, tra il 1951 e il 1952 toccò al chirurgo statunitense David M. Hume (1917 – 1973 ) al Peter Bent Brigham Hospital di Boston eseguì una serie di trapianti renali inseriti nella coscia dei riceventi con uretere libero provenienti da donatori deceduti durante interventi chirurgici. Alcuni dei riceventi vennero trattati con l’ormone adrenocorticotropo (ACTH), cortisone e testosterone ma pochi mostrarono di funzionare per qualche mese, prima di essere rigettati.
Sebbene le esperienze di Parigi e di Boston confermassero l’inutilità degli allotrapianti renali, secondo l’opinione della maggior parte dei clinici dell’epoca, con la dimostrazione che tale sperimentazione fosse ingiustificata e non etica, questi due eventi contribuirono, invece, in seguito, a sostenere la speranza che negli esseri umani l’esito dei trapianti poteva essere migliore di quanto si era osservato dapprima negli animali e a lanciare così l’età moderna dei trapianti con lo stimolo di nuove ricerche.
I primi successi trapiantologici e gli xenotrapianti

A Boston, appena 14 mesi dopo il rapporto iniziale sulla tolleranza nei topi chimerici nel 1951 da parte del biologo britannico Rupert Billingham e di Peter Medawar, giunse il punto di riferimento successivo.
Il 23 dicembre del 1954 il chirurgo statunitense Joseph Murray (1919 – 2012), vincitore del Premio Nobel per la Medicina nel 1990, al Peter Bent Brigham Hospital, aprì la barriera del rigetto portando a termine con successo il primo trapianto di reni tra gemelli identici (i gemelli Herrick) della storia con il rene impiantato secondo la tecnica ideata da R. Kuss.
Il trapianto ebbe una sopravvivenza di otto anni. Il suo successo non rappresentava una novità poiché si sapeva già da decenni che gli innesti cutanei scambiati tra gemelli monocoriali non venivano respinti; tuttavia il suo impatto, grazie all’esito favorevole, fu immediato e profondo, tanto da essere da stimolo per nuovi trapianti tra altri gemelli.
come gli innesti cutanei
I reni si comportavano proprio come era stato dimostrato negli innesti cutanei: gli autotrapianti e gli isotrapianti sopravvivevano a lungo termine mentre gli allotrapianti solo qualche giorno o al massimo qualche settimana.
L’anno successivo l’immunologo statunitense Richmond Prehn, insieme alla sua assistente Joan Main, dimostrò che l’indebolimento del sistema immunitario di topi adulti con le radiazioni permetteva loro di indurre chimerismo, inoculando cellule del midollo osseo.
Questi studi e l’analogo successo di un omotrapianto di rene nel cane furono altri motivi che incoraggiarono il proseguimento dei trapianti per prevenire il rigetto degli allotrapianti nell’uomo.
trapianto dopo l’inoculazione del midollo osseo del donatore

Nel 1958 Murray utilizzò la strategia di Prehn in due riceventi di rene che furono irradiati (TBI) dopo l’inoculazione del midollo osseo del donatore. Altri 12 pazienti subirono lo stesso trattamento ma undici di questi morirono entro un mese mentre il sopravvissuto mantenne la funzionalità renale per venti anni. Scientificamente, questo risultato risultò più importante rispetto a trapianto del gemello identico, poiché fu la prima volta che la barriera immunologica al trapianto di rene umano veniva violata.
Cinque mesi dopo a Parigi il chirurgo francese Jean Hamburger, utilizzando lo stesso trattamento di irradiazione, ebbe successo con un altro trapianto di rene tra gemelli fraterni che funzionò sino alla morte del paziente per cause non correlate 26 anni dopo.
CHIMERISMO O NO

In questi due casi di gemelli dizigoti, si ipotizzò che il donatore e il ricevente, fossero diventati chimerici attraverso lo scambio di cellule del sangue tollerogeniche durante la gestazione.
Tra il 1960 e il 1962 a Parigi J. Hamburger e R. Kuss dimostrarono che il chimerismo non era necessario eseguendo quattro trapianti renali di successo in non gemelli condizionati dall’irradiazione total body. Questa esperienza francese rimase la principale e forse l’unica prova per dimostrare che il chimerismo non era necessario per il successo dei trapianti.
La Comunità Scientifica iniziò così ad indagare sulla eventualità di utilizzare i farmaci immunosoppressivi (dapprima la 6 – MP, poi l’azatioprina e infine i corticosteroidi) che miglioravano i risultati, almeno, a breve termine, in alternativa all’irradiazione totale del corpo, portando ad un ampiamento del pool di donatori, poiché, la risposta immunitaria agli organi estranei poteva essere soppressa.
coma depassè
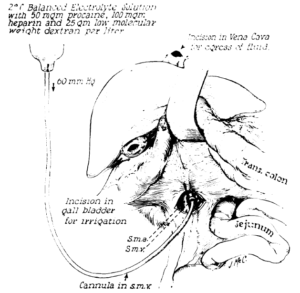
Sempre nel 1962, J. Murray eseguì il primo trapianto renale tra pazienti non correlati utilizzando l’azatioprina il cui risultato rappresentò un caso emblematico rappresentando il primo trapianto renale riuscito da donatore cadavere, dato che sinora i trapianti coronati da successo erano stati quelli da vivente.
Nel 1963 il chirurgo belga Guy Alexandre (1934 – 14febbraio 2024), che aveva introdotto l’idea del coma depassè, un altro tipo di coma più profondo, all’Hospital San Pierre di Bruxelles eseguì un trapianto renale utilizzando il rene di questo donatore, risultando questo la prima donazione dopo quella della morte cerebrale.
Negli anni successivi (periodo di consolidamento), l’evoluzione della pratica medica rese relativamente comune e semplice anche altri tipi di trapianto extrarenali.
TRAPIANTI EXTRA-RENALI
Infatti, mentre i primi anni di trapianto, si concentrarono per la maggior parte su quelli renali, furono anche eseguiti con un certo successo altri tipi di trapianti solidi come quelli di fegato, pancreas, cuore e polmone Questi ultimi trapianti rappresentarono gli anni dell’inizio della moderna trapiantologia, dove i chirurghi conseguirono alcuni successi spettacolari.
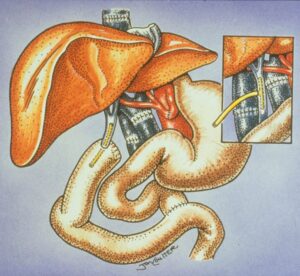
Nel 1963 il chirurgo statunitense Thomas Starzl (1926 -2017), definito il padre della trapiantologia moderna, praticò il primo trapianto di fegato al mondo su un bambino di tre anni affetto da atresia delle vie biliari a Denver nel Colorado, e nello stesso anno un altro chirurgo statunitense, James Hardy (1918 – 2003), effettuò il primo trapianto di polmone all’Università del Mississippi Medical Center di Jackson, in un paziente affetto da carcinoma bronchiale che morì, poi, 18 giorni dopo l’intervento.
DAL RENE AL CUORE

Nel frattempo, il trapianto di rene incominciò ad essere gradualmente un intervento di routine, tanto che nel 1965 il Registro dei Trapianti Renali di Boston attestava in tutto il mondo 672 trapianti renali effettuati da uomo a uomo. Nel 1966 venne effettuato dal chirurgo statunitense Richard C. Lillehei a Minneapolis, nel Minnesota, anche il primo trapianto di pancreas.
Nel 1967 T. Starzl ritentò nuovamente il trapianto di fegato su pazienti affetti da diverse malattie aiutato dai suoi precedenti risultati ottenuti sul modello canino e dalla azatioprina e steroidi come immunisoppressori. Gran parte degli interventi eseguiti ebbero successo anche se alcuni dei pazienti, sopravvissuti all’operazione, morirono poco tempo dopo per malattie non correlate al trapianto. Successivamente, nel 1970, perfezionando la tecnica chirurgica da trapianto eterotopico a trapianto ortotopico, la conservazione degli organi e l’immunsoppressione, i tassi di sopravvivenza per i trapiantati di fegato ad un anno salirono dal 25 % al 40%.
Christiaan Barnard

Nel dicembre del 1967, un altro trapianto che suscitò scalpore in tutto il mondo fu il primo trapianto di cuore, ad opera del chirurgo sudafricano Christiaan Barnard (1922 -2001) nella Clinica Groote – Schuur di Città del Capo in Sudafrica. Barnard trapiantò il cuore di una donna di colore nel petto di un uomo bianco ma non essendo stato ancora definito, a quel tempo, il concetto di “morte cerebrale” , egli dovette attendere che il cuore della donatrice cessasse di battere prima di iniziare il trapianto cardiaco. Il paziente sopravvisse per 18 giorni.
Tra il 1967 e il 1969 nacque anche la prima Organizzazione per lo scambio degli organi (Organ Sharing) grazie a J. van Rood, l’Eurotransplant, e nel 1968 la prima legge unitaria sui trapianti di organi negli U.S.A. e nello stesso anno il primo trapianto di cuore da parte del cardiochirurgo statunitense Norman E. Shumway (1923 – 2006) alla Stanford University di Palo Alto, in California.
ULTERIORI PROGRESSI
Nel corso degli anni successivi ci furono ulteriori progressi: nel 1981 da parte del cardiochirurgo statunitense Bruce Reitz che guidò il primo trapianto combinato cuore – polmone con N. Shumway al Stanford Medical Center in California e nel 1982 l’impianto di un cuore totalmente artificiale da parte, invece, del cardiochirurgo statunitense William de Vries (1943 – ) a Salt Like City, nello Stato dell’Utah, con una sopravvivenza di 112 giorni, utilizzando il modello Jarvik – 7.
Questi organi artificiali, continuamente soggetti a costante miglioramento, nel 1990 sono stati impiantati in più di 150 pazienti quando i loro cuori erano troppo danneggiati e nell’attesa del trapianto.
MICROCHIMERISMO

Negli stessi anni ‘80 veniva elaborata la teoria del microchimerismo da T. Starzl che rappresentò il presupposto fondamentale per l’accettazione a lungo termine dell’organo da parte dell’ospite tramite scambio di leucociti tra l’organo trapiantato e il ricevente.
Nel 1988 il chirurgo tedesco Rudolf Pichlmayr introdusse alla Hannover Medical School la tecnica dello split liver in cui il fegato del donatore poteva essere diviso in due porzioni e impiantato in due riceventi di trapianto: una più piccola utilizzata per un ricevente pediatrico mentre l’altra più grande per un ricevente adulto.
E ancora, importanti sono state le terapie di induzione con anticorpi policlonali e monoclonali in grado di eliminare le cellule responsabili del rigetto per la riprogrammazione del Sistema Immunitario del ricevente al momento del trapianto.
NUOVE TERAPIE
 Ciò ha permesso una notevole diminuzione delle dosi di farmaci immunosoppressori. L’utilizzo di questi anticorpi e l’avvento di nuovi farmaci immunosoppressori, quali il Micofenolato Mofetile o MMF e la Rapamicina, hanno così consentito di eliminare l’impiego degli steroidi come farmaci dagli schemi di immunosoppressione dei pazienti trapiantati riducendo gli effetti collaterali a lungo termine migliorando la qualità di vita dei pazienti.
Ciò ha permesso una notevole diminuzione delle dosi di farmaci immunosoppressori. L’utilizzo di questi anticorpi e l’avvento di nuovi farmaci immunosoppressori, quali il Micofenolato Mofetile o MMF e la Rapamicina, hanno così consentito di eliminare l’impiego degli steroidi come farmaci dagli schemi di immunosoppressione dei pazienti trapiantati riducendo gli effetti collaterali a lungo termine migliorando la qualità di vita dei pazienti.
Nel 1992 si arrivò anche al trapianto di intestino e di visceri addominali e nel 1993 lo sviluppo del primo trapianto di isole pancreatiche come tentativo di curare il diabete, evitando agli stessi pazienti di doversi sottoporre al trapianto di pancreas in toto da parte del chirurgo finlandese Carl Gustav Groth (15ottobre 1933 – 16febbraio 2014).
SUINI TRANSGENICI
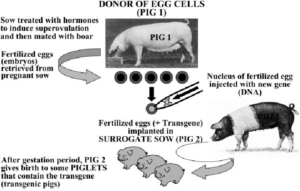
Successivamente nel 1995 ci fu anche la creazione dei primi suini trangenici (hDAF) cioè dei primi maiali ingegnerizzati prodotti dal gruppo dell’ingegnere genetico inglese David White (1946-2017) della Cambridge University, per essere trapiantati sull’uomo con il tentativo di abrogare il rigetto accelerato che normalmente sconfigge gli xenotrapianti. Si trattava di una scrofa, subito battezzata con il nome di Astrid.
Inoltre, agli inizi degli anni 2000 si provvide a perfezionare la tecnica del trapianto e l’impiego delle cellule staminali ematopoietiche per favorire l’accettazione dell’organo con la pubblicazione del primo protocollo di induzione di tolleranza al trapianto di rene in cui si trapiantavano simultaneamente le cellule staminali ematopoietiche e il rene dello stesso donatore per una quasi completa sospensione della terapia immunosoppressiva, mentre si apriva la strada al trapianto di trachee ingegnerizzate per la ricostruzione su misura di organi non immunogenici.
TRAPIANTO DI ARTI e faccia

L’ultima frontiera nella storia dei trapianti avvenne a Lione con il medico francese Jean Michel Dubernard (1941 – 2021) nel mese di settembre del 1998 con il primo innesto di mano e di avambraccio creando i presupposti per una nuova e futura medicina e per aver assistito nel novembre del 2005 il chirurgo facciale francese Bernard Devauchelle (1950 – ) nell’esecuzione del primo trapianto parziale di faccia nel novembre del 2005.
Ritornando agli anni anni ‘60, sebbene i trapianti renali si consolidassero sempre di più, rimaneva ancora da risolvere il problema della scarsità degli organi e il non uso ancora della dialisi; si ritornò così alla sperimentazione degli xenotrapianti anche se i tentativi passati erano tutti falliti per problemi di incompatibilità tissutale.
Il primo a trapiantare reni di primati nell’uomo fu il chirurgo statunitense Keith Reemtsma, che alla Tulane University della Louisiana, nel 1964, effettuò ben 13 xenotrapianti. La maggior parte di questi, fallì nell’arco di 4 – 8 settimane per rigetto o per complicanze infettive mentre solo un paziente riuscì a sopravvivere per ben 9 mesi.
cuori di babbuino e scimpanzè

Questa esperienza, successivamente, indusse il cardiochirurgo statunitense J. D. Hardy che dopo aver eseguito più di quattrocento trapianti di polmone sui cani a percorrere questa strada anche per i trapianti di cuore.
Un cuore di scimpanzè venne trapiantato ad un uomo con una malattia aterosclerotica avanzata, già semicomatoso al momento dell’intervento. Il paziente morì dopo un paio d’ore. Tuttavia, questo xenotrapianto nonostante venisse ampiamente criticato per motivi etici, morali, religiosi e anche legali, aprì le porte ai futuri trapianti cardiaci.
Nel 1977 Christiaan Barnard, noto per aver eseguito una decina d’anni prima il primo trapianto di cuore umano riuscito, cercò di usare cuori di babbuino e di scimpanzè come pompe di appoggio temporaneo in due pazienti il cui cuore non funzionava correttamente, dopo un intervento.
ORGANI ANIMALI
Gli organi animali risultarono però essere troppo piccoli e soggetti a rigetto per cui i pazienti non riuscirono a sopravvivere.
Diversi anni dopo, invece, nel 1984, fu la volta del chirurgo statunitense Leonard Lee Bailey (1942 – 2019), al Loma Linda University Medical Center, che collocò il cuore di un babbuino nel petto di una piccola paziente, Baby Fae, di un mese nata prematuramente con la sindrome del cuore sinistro ipoplasico, cioè con uno sviluppo anomalo delle strutture cardiache sinistre. La bimba sopravvisse per 21 giorni a causa del rigetto acuto del trapianto nonostante l’impiego della ciclosporina introdotta come farmaco immunosoppressore nella pratica clinica.
SITUAZIONE CLINICHE DISPERATE

Tra i più celebri tentativi, sono anche da annoverare quelli effettuati dal chirurgo americano Thomas Starzl con i fegati di babbuino trapiantati a due pazienti negli anni ’90, uno dei quali riuscì a sopravvivere per 70 giorni.
Gli xenotrapianti vennero consentiti a causa di una situazione clinica disperata per la mancanza di organi trapiantabili come il cuore a misura di infante. Tuttavia, nonostante l’avvento della dialisi e della maggiore disponibilità di organi da donatore cadavere ascrivibile alla definizione di morte cerebrale, della scoperta di anticorpi naturali eterofili e dell’impiego della ciclosporina, le sue ricerche non furono mai abbandonate.
L’INGEGNERIA GENETICA AL SERVIZIO DEI TRAPIANTI
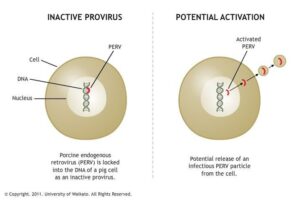
Esse proseguirono, successivamente, con gli studi di ingegnerizzazione di animali, specie dei maiali, che portarono alla comprensione della causa dei fallimenti degli xenotrapianti imputabili ad una reazione di rigetto da parte di anticorpi xenoreattivi naturali dell’uomo. Questi anticorpi riconoscevano strutture molecolari rappresentate da residui carboidratici galattosio – alfa -1,3 galattosio (Gal) prodotti da un enzima (alfa -1,3 galattosil transferasi codificato da un solo gene) sull’endotelio vascolare del maiale. Si trattava di una reazione immunologica che si manifestava nell’arco di pochi minuti (rigetto iperacuto) mediata dal sistema complementare. Questa scoperta portò allo sviluppo di metodologie sperimentali per creare animali transgenici in maniera tale da prevenire il rigetto attraverso l’eliminazione o l’inibizione degli anticorpi e del complemento del ricevente.
contro il rigetto iperacuto

Anche con questi notevoli progressi, rimanevano ancora aperte diverse problematiche che riguardavano da una parte la funzionalità degli organi del maiale se in grado di adempiere alle necessità metaboliche proprie dei tessuti umani e dall’altra i rischi di eventuali infezioni legati a virus suini da poter essere trasmessi all’uomo. Nel genoma suino risiedono dei retrovirus silenti, i cosiddetti provirus come il citomegalovirus del maiale (pCMV), l’herpes virus linfotropico di maiale (pHLV), il virus dell’epatite E (HEV) e i retrovirus endogeni del maiale (Porcine Endogenous RetroVirus o PERV), cioè sequenze di DNA potenzialmente in grado di dirigere la produzione di particelle virali infettive (l’1% del DNA umano è costituito da simili geni virali) che incorporandosi direttamente nel DNA dell’ospite possono scatenare infezioni.
Di questo aspetto si è già occupato qualche anno fa dal genetista statunitense George Church (1954 – ), uno dei pionieri di CRISPR , che nel 2015 ha eliminato le sequenze virali dal genoma del maiale grazie all’editing genomico.
PROVIRUS E DNA ANIMALE
Queste sequenze devono la propria esistenza a passate infezioni retrovirali, durante le quali i virus inserirono il proprio materiale genetico in spermatozooi o cellule uovo dei progenitori degli attuali animali. La progenie degli animali infettati ha conservato i geni virali che poi sono stati trasmessi di generazione in generazione e anche se nel tempo la maggior parte di questi virus si sia evoluta in forme innocue per i propri ospiti, alcuni di essi potrebbero, ancora, essere capaci di causare malattie in altre specie. Questo eventuale trasferimento non solo permetterebbe al virus di accedere direttamente alla cellula umana ma potrebbe presentargli una vittima sensibile a causa di un Sistema Immunitario indebolito dai trattamenti anti – rigetto e in questa situazione, i provirus suini si trasformerebbero in retrovirus attivi in grado di causare malattie.
nuove fonti di organi
Questi retrovirus di maiale potrebbero anche mutare nei pazienti oppure combinarsi con i retrovirus umani, dando origine a dei nuovi potenziali patogeni. Tutto ciò, diventerebbe pericoloso perché diversamente dai virus suini che causano una breve sindrome simil-influenzale, alcuni retrovirus sono parzialmente cancerogeni, producendo delle infezioni di lunga durata.
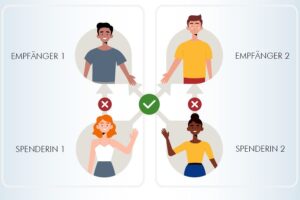
Nel frattempo, per supplire alla carenza di organi si individuarono alcune nuove fonti di organi e di cellule oltre al miglioramento delle tecniche di prelievo post-morten dei tessuti da pazienti dei quali era stata accertata non solo la morte cerebrale ma anche quella cardiaca. Nello stesso tempo, si incrementarono le possibilità di trapianti da donatori viventi correlati e non (trapianto cross-over) e da donatori marginali (trapianto da ultrasessantenni di doppio rene) in precedenza considerati non adatti allo scopo. Tra le fonti alternative, l’utilizzo di cellule staminali e di linee cellulari per produrre in vitro o in vivo i tessuti richiesti.
La scoperta della ciclosporina e di altri farmaci immunosoppressivi dagli anni ‘70
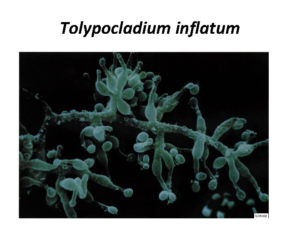
Nonostante i successi chirurgici ottenuti, il rigetto degli organi trapiantati continuava a rimanere un serio problema e così agli inizi degli anni ‘70 accadde qualcosa che diede inizio ad una nuova fase nella storia della medicina dei trapianti. L’immunologo belga Jean Francois Borel, a Basilea, in Svizzera, mentre lavorava presso i Laboratori della Sandoz scoprì le proprietà anti-rigetto di una sostanza estratta da un fungo, il Tolypocladium inflatum gums, la ciclosporina, un polipetide ciclico composto da circa 11 aminoacidi ad azione immunosoppressiva in grado di bloccare i meccanismi che attivano le risposte immunitarie mediate dai linfociti T. Negli anni ‘80 questo nuovo farmaco immunosoppressivo ricevette l’omologazione definitiva per il suo uso commerciale e il suo utilizzo migliorò la sopravvivenza dei pazienti trapiantati dal 20% al 70%, rappresentando un vero e proprio spartiacque tra l’epoca pre- e post- ciclosporina.
CICLOSPORINA E TACROLIMUS
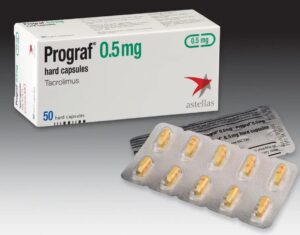
Nel 1989 si celebrò il centomillesimo trapianto di reni a livello mondiale e nel 1991 in alternativa alla ciclosporina, si incominciò ad utilizzare un altro farmaco anti-rigetto il Tacrolimus o Prograf, un antibiotico macrolide derivato dal fungo Streptomyces tsukubaensis, molto più potente a parità di volume.
Pur avendo, questi due farmaci immunosoppressivi, una struttura molecolare diversa, entrambi possiedono, però, simili caratteristiche farmacologiche ed un simile meccanismo d’azione consistente nell’inibizione della calcineurina intra-cellulare, una proteina con attività fosfatasica, anche nota come PPP3CA (protein fosfatasi 3).
NUOVE CONOSCENZE SUL FENOMENO DEL RIGETTO
Nel 2000, dieci anni più tardi, a livello planetario furono trapiantati circa 470.000 reni, 74.000 fegati, 54.000 cuori e 10.000 polmoni.
Le nuove conoscenze sulla complessità del sistema immunitario e degli eventi che costituivano il rigetto, permisero un continuo miglioramento nel controllo di quest’ultimo sia a livello molecolare che cellulare con l’introduzione di altri farmaci immunosoppressivi entrati a far parte di quel bagaglio farmacologico, utile a prevenire il rigetto:
a) Micofenolato Mofetile o Cell Cept, Micofenolato sodico o Myfortic, Mizoribine o Bredinin, che esercitano tutti i loro effetti sul sistema immunitario mediante l’inibizione della sintesi de novo delle purine.
b) Sirolimus o Rapamicina o Everolimus, che ha come bersaglio una serina treonina chinasi (mTOR mechanistic Target of Rapamycin) che regola la crescita, la proliferazione, la motilità e la sopravvivenza delle cellule.
EVOLUZIONE DELLA FARMACOLOGIA
c) ATG o globulina anti-timocitaria (derivata da coniglio), ATGAM (derivata da cavallo): queste due formulazioni (anticorpi policlonali) condividono un meccanismo d’azione comune incentrato sulla loro interazione con i marcatori della superficie cellulare delle cellule immunitarie, con effetti immunosoppressivi.
d) Basiliximab o Simulect, Daclizumab o Zenapax : entrambi si legano alla catena α chain (CD25) del recettore dell’IL-2 nelle cellule T.
Lo sviluppo di nuovi farmaci anti rigetto, unitamente alla creazione di istituzioni nate per l’attribuzione e la conservazioni di organi, consentirono di fatto non solo trapianti di rene, di fegato, di cuore, di pancreas , di polmone, di intestino, di visceri addominali, di tessuti e di cellule staminali ematopoietiche ma anche il primo trapianto di mano nel 1998, di cuore artificiale nel 2001 e nel 2008 l’esecuzione con successo un trapianto di entrambe le braccia e del primo trapianto di trachea umana. Nel 2010, invece, il primo trapianto di viso completo mentre il primo trapianto parziale venne realizzato nel 2005.
La ricerca di alternative: gli xenotrapianti con animali geneticamente modificati e gli organi bioartificiali

Nei primi studi clinici tra le specie donatrici di organi per trapianto, figuravano i primati non umani in quanto le fonti umane erano scarse. Tuttavia, ogni tentativo di xenotrapianto rappresentava un fallimento attribuito a incompatibilità tissutale, tossicità e con nessuno agente immunosoppressivo promettente nei riceventi, da suggerire un superamento della barriera di specie.
L’uso di scimmie antropomorfe, pur vantaggioso per diversi aspetti, presentava il problema dell’eccessiva somiglianza tra le specie, rendendo molto più facile la trasmissione di malattie all’uomo. E’ per questo motivo che l’attenzione dei ricercatori si è spostata verso il maiale quale potenziale specie donatrice per l’uomo. Il maiale, infatti, oltre ad avere anatomia e fisiologia per molti aspetti simili all’uomo, comporta minori problemi di natura etica e permette di ottenere rapidamente un grande numero di donatori grazie al breve periodo di gestazione, alla pluriparità e alla rapida crescita della progenie.
Verso la fine degli anni ‘90, nel tentativo di superare il problema del rigetto in particolare quello iperacuto (avviene a distanza di minuti o ore dal trapianto a causa del legame di anticorpi del ricevente formatisi prima del trapianto d’organo e successiva attivazione della cascata del complemento che determina un danno endoteliale severo, formazione di trombi e deposito di fibrina nei capillari del trapianto, il cui risultato finale è una rapida e irreversibile perdita dell’organo) ma anche rigetto acuto anticorpo – mediato (avviene a distanza di giorni o mesi dal trapianto ed è solitamente indotto dalla produzione da parte del ricevente di una risposta anticorpale de novo che comprende deposizione di IgM, IgG, C4d e C5b-9, verso antigeni dell’organo trapiantato), si incominciarono a sviluppare dei metodi sperimentali per la creazione di animali transgenici, soprattutto maiali, come possibile serbatoio da cui attingere organi da destinare al trapianto. Questo ritorno di interesse era legato alle recenti innovazioni tecnologiche come la transgenesi, modificando il patrimonio genetico dell’animale. Agli inizi la produzione di suini geneticamente modificati che rappresentavano gli animali tra i più utilizzabili per gli xenotrapianti, sia per le caratteristiche legate alla specie (progenie più numerosa, tempi di gestazione breve), sia per caratteristiche fisiologiche simili a quelle umane e sia anche per motivi collegati alla possibilità di clonarli, era difficile e richiedeva soprattutto tempi prolungati. Successivamente, i progressi nell’editing genetico con le nucleasi a dita di zinco (ZFN, Zinc finger nucleases), con le nucleasi effettrici simili all’attivatore della trascrizione (TALEN) e più di recente con la tecnologia CRISPR – Cas9, la produzione di maiali geneticamente modificati si è resa più facile, facendo ritornare di moda gli xenotrapianti.
L’inserimento di geni di provenienza umana con l’editing genetico CRISPR, un intervento di precisione basato sull’impiego della nucleasi Cas-9, la cui scoperta è stata premiata con il Nobel per la Chimica nel 2020, ha permesso di accendere (knock-in) o spegnere (knock- out) un gene come quello responsabile dello xeno-antigene ɑ – Gal (Galα(1,3)Galβ4Glc-Nac-R), un dimero di galattosio (Galα(1,3)Gal) legato alla N-acetil-lattosamina, sintetizzato dall’enzima α 1,3 galactosiltransferasi (α1-3 GalT), enzima presente nei mammiferi ma non nell’uomo e nei primati non umani del Vecchio Mondo.
In questo modo, si è reso possibile modificare il genoma dell’animale per superare le barriere biologiche da una specie all’altra, facilitando il processo di integrazione dell’organo e per ridurre, anche, eventuali rischi di infezioni come la presenza di Retrovirus silenti ospitati nel genoma dei maiali. L’αGal non è stato, però, l’unico epitopo glucidico riconosciuto dagli anticorpi xeno-reattivi umani. Infatti, grazie a ricerche pre-cliniche degli ultimi anni, sono stati individuati altri due target glucidici supplementari, il Neu5GC e il Sda.
L’antigene Neu5GC fa parte della famiglia degli acidi sialici e deriva dalla dalla idrossilazione dell’acido N acetilneuraminico (Neu5AG). Tale reazione è catalizzata dall’enzima CMP-Neu5Ac-idrossilasi (CMAH) presente nei tessuti di molti mammiferi ma non nell’uomo. Per questa ragione tale residuo risulta essere immunogenico per l’uomo.
Anche in questo caso è stato possibile ottenere maiali ingegnerizzati privi degli enzimi α1-3 GalT e CMAH e il loro impiego ha dimostrato di avere effetti benefici al fine di diminuire sia il legame che la citotossicità degli anticorpi umani diretti contro le cellule di maiale.
Studi successivi hanno, ancora, dimostrato che quasi il 100% dei sieri umani possiede anche IgM e IgG dirette verso l’Sda, un antigene di un gruppo sanguigno raro sintetizzato dalla β1,4-N acetilgalactosamiltranferasi.
Poichè, circa il 40% degli organi trapiantati viene perso entro i 10 anni e un’alta percentuale soffre di effetti collaterali, la ricerca si è così concentrata a partire dal 2021 a nuovi studi clinici su xenotrapianti di reni e di cuori.
Xenotrapianti di rene

Grazie ai diversi progressi scientifici ottenuti verso la fine del XX secolo e nei primi anni del XXI secolo e successivi, tra cui le modifiche genetiche e la clonazione, lo xenotrapianto si è avvicinato alla realtà, rendendo possibile la modifica di geni degli animali per rendere gli organi più compatibili e meno suscettibili al rigetto del Sistema Immunitario con un candidato ideale: il maiale.
Secondo i dati del Centro Nazionale Trapianti attualmente in Italia circa 8.000 le persone con malattie renali, epatiche, cardiache e polmonari sono alla ricerca della disponibilità di organi per trapianti: 5800 attendono un nuovo rene, 1000 un fegato, 700 un cuore, 200 un pancreas e 5 l’intestino. Purtroppo. Gli organi disponibili sono troppo pochi e la carenza cronica di donatori umani ha reso necessario l’esplorazione di altre strade come gli xenotrapianti.
Ma quali sono state le tappe di riavvicinamento agli xenotrapianti?
Il 25 settembre del 2021 è stato eseguito al Langone Transplant Institute di New York City uno xenotrapianto di rene di maiale Gal knock-out in una donna dichiarata morta cerebralmente con segni di disfunzione renale che non soddisfava ai requisiti per una donazione di organi, tenuta in vita artificialmente mediante ventilazione. Il rene è stato collegato esternamente al suo corpo. Durante le 54 ore di osservazione, la donna ha eliminato una quantità tale di urina da migliorare il suo livello di creatinina senza dar luogo a problemi di rigetto, fino a che non è stata sospesa la respirazione artificiale che la teneva in vita.
In questo esperimento, il rene suino trapiantato, allo scopo di ridurre il rischio di un rigetto umorale immediato, ha ricevuto il gene – knock out dell’unico gene (3 – galattosil transferasi) che produce ɑ- Gal (galattosio ɑ 1 -3 galattosio), l’epitopo di cui è ricco il rene del maiale espresso sulla superficie di glicolipidi e glicoproteine dell’endotelio vascolare riconosciuto estraneo dal sistema immunitario di primati compresi gli esseri umani che per contro producono anticorpi naturali anti ɑ -Gal di tipo IgM e IgG xenorettivi che portano al rigetto immediato del trapianto) per mezzo della tecnologia CRISPR-Cas 9.
Questo primo esperimento ha rappresentato una soluzione a breve termine per quei pazienti in lista d’attesa fino a che che non sarà per loro disponibile un rene umano o come trapianto permanente. Inoltre, ha rappresentato anche una svolta perché ha contribuito a dare il via per altre nuove sperimentazioni dimostrando che la delezione dell’epitopo oligosaccaridico ɑ – Gal presente nel rene del maiale, noto per provocare il rigetto iperacuto negli xenotrapianti, può essere spento (Gal knock – out) per bloccare le barriere immunologiche.
Nel mese di agosto 2023 è stato pubblicato, invece, sulla Rivista Jama Surgery da un gruppo di ricercatori dell’Università dell’Alabama al Birmingham Heersink School of Medicine, U.S.A. ), uno studio che raccoglie i risultati di uno xenotrapianto di rene per trattare i casi più gravi e terminali di malattia renale cronica. Le sperimentazioni precliniche e cliniche precedenti, tra cui quella del New York Langone Health, avevano dimostrato la produzione di urina da parte dell’organo, ma non la clearance della creatinina. Quest’ultima sostanza che viene prodotta dalla degradazione della creatina, è una proteina che si trova nei muscoli scheletrici e nel cuore con funzione di fonte di energia. Quando rilasciata nel sangue, per poi arrivare ai reni viene eliminata tramite le urine. La misura di questo valore permette di indagare la funzionalità del rene.
Se il rene di maiale trapiantato non è in grado di sopperire a questa funzione, l’organismo umano non può sopravvivere. Nello studio è stato valutato un uomo di 50 anni dichiarato in morte cerebrale e supportato dalle macchine. Gli animali donatori sono stati sottoposti a dieci modifiche genetiche per abbassare la probabilità di rigetto dell’organo tra cui quattro knock – down e knock -out genici e sei inserzioni di transgeni umani mantenuti in una struttura priva di patogeni, per abbassare le probabilità di rigetto. I risultati sono stati interessanti, pur essendo molto limitati. L’uomo con un danno renale acuto in aggiunta alla malattia cronica e all’ipertensione è stato sottoposto al trapianto di entrambi i reni e trattato con farmaci immunosoppressori. Dopo lo xenotrapianto renale i valori di creatinina sierica si sono normalizzati nel giro di 48 ore e la clearance è migliorata. Lo studio, anche se su un caso singolo, rappresentava comunque una prima prova di fattibilità.
Sempre restando in questo tema, nel 2023, viene riportata sulla rivista Nature la sopravvivenza di due anni di un trapianto con rene di un maiale geneticamente modificato in un primate non umano: uno dei periodi più lunghi registrati finora per un trapianto d’organo interspecie. I ricercatori di questa sperimentazione della biotech eGenesis e dell’Harvard Medical School descrivono il successo del trapianto di reni di maiali, in miniatura e modificati geneticamente, in scimmie della specie Macaca fascicularis, dove vengono evidenziate le numerose modifiche in numero di 69 apportate al genoma del maiale, in vivo e in vitro, e giustificate per superare gli ostacoli immunologici del trapianto di organi di maiale negli esseri umani, e a prolungare la sopravvivenza degli organi trapiantati.
Il 21marzo 2024 è stato, invece, eseguito al Massachusetts General Hospital, di Boston U.S.A., il primo trapianto al mondo di rene di maiale geneticamente modificato in un uomo di 62 anni affetto da malattia renale allo stadio terminale e immunosoppresso con due nuovi farmaci il tegoprubart, fornito da Eledon Pharmaceuticals, e il ravulizumab, fornito da Alexion Pharmaceuticals. Questo intervento ha segnato un ulteriore traguardo nella storia degli xenotrapianti, che fino ad ora erano rimasti limitati ad animali o esseri umani in stato vegetativo.
Anche se il paziente è riuscito a sopravvivere solo per quasi due mesi, questo xenotrapianto ha inaugurato un nuovo capitolo nella storia dei trapianti. Il ricevente conviveva da molti anni con il diabete di tipo 2 ed aveva ricevuto in precedenza un trapianto di rene da un donatore cadavere nel dicembre 2018, eseguito sempre al Massachusetts General Hospital dopo essere stato in dialisi per sette anni. Il rene trapiantato è stato poi rigettato cinque anni dopo per poi costringere il paziente a riprendere nuovamente la dialisi nel 2023.
Poiché il trattamento dialitico gli aveva causato delle complicazioni ricorrenti con grave impatto sulla sua qualità di vita, è stato decido di eseguire uno xenotrapianto nell’ambito di un singolo protocollo di accesso allargato della FDA (Food and Drug Administration) in una forma di uso compassionevole, in genere, concesso per un singolo paziente o per alcuni pazienti con malattie o condizioni gravi e potenzialmente letali per poter accedere a trattamenti o a prove sperimentali quando non esistono opzioni di trattamento o terapie.
Il rene per lo xenotrapianto era stato fornito dall’azienda eGenesis di Cambridge (Massachusetts) e modificato geneticamente con la tecnologia di editing genomico CRISPR per un totale di ben 69 modifiche ideate per prevenire il rigetto dell’organo e ridurre il rischio di infezione nel ricevente da parte di un retrovirus endogeno nell’organo suino.
L’ultimo trapianto di rene da suino con un solo gene editato è stato effettuato il 22aprile del 2024 sempre presso il Langone Health di New York su una donna, i cui severi problemi cardiaci le impedivano di ottenere un rene convenzionale mentre la necessità di un trattamento dialitico ostacolava un intervento al cuore. A rendere ancora più speciale questo intervento chirurgico è stato il fatto che oltre allo xeno-rene le è stato anche trasferito il timo per favorire l’accettazione dell’organo animale. Purtroppo nel corso del tempo la sua pressione sanguigna è diminuita molteplici volte, danneggiando l’irrorazione del rene che nel tempo ha perso la sua funzionalità, al punto tale da doverle sospendere i farmaci immunosoppressori e rimuovere il rene trapiantato dopo 47 giorni.
Xenotrapianti di cuore
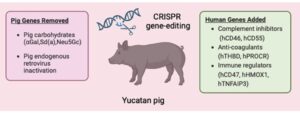
Negli ultimi anni sono stati trapiantati, anche, cuori di maiale modificati geneticamente in due pazienti. Il primo era un uomo di 57 anni affetto da un grave patologia cardiaca. Nel mese di gennaio del 2022 ha ricevuto un trapianto cardiaco, al Medical Center dell’Università del Maryland di Baltimora, da un maiale adattato dalla Società Revivicor in corrispondenza di dieci geni e rimasto in vita per 60 giorni. Si è scoperto che il decesso era dovuto ad un virus suino latente riattivatosi dopo lo xenotrapianto, sfuggito ai controlli preliminari, le cui tracce genetiche sono state identificate, poi, nello xeno-organo solo post-mortem.
In aggiunta, è stata avanzata un’altra ipotesi, che la terapia immunostimolante, somministrata per combattere un’altra infezione, composta da un mix di anticorpi provenienti da migliaia di donatori, avesse danneggiato irreversibilmente il cuore.
Tuttavia sarebbe sbagliato concludere che il filone degli xenotrapianti stia deludendo le aspettative: i singoli interventi autorizzati in regime compassionevole hanno impartito a chirurghi e a ricercatori utili lezioni in vista delle prime sperimentazioni cliniche che la Food and Drug Administration (FDA) statunitense potrebbe autorizzare nei prossimi anni.
Quali possono essere stati gli insegnamenti ottenuti da questo xenotrapianto?
a) effettuare un migliore controllo degli animali per evitare di usare donatori esemplari portatori di infezioni nascoste;
b) escludere eventuali anticorpi reattivi da campioni messi a disposizione dalle banche per eventuali trattamenti post-trapianto.
Occorre, inoltre, tenere presente che tale paziente aveva alle spalle una storia clinica lunga e travagliata. Infatti, prima dello storico intervento era già stato operato più volte e attaccato alla macchina da più di un mese per la circolazione extracorporea. Non essendo, quindi, in grado di scalare le liste d’attesa e ottenere organi convenzionali a causa delle condizioni troppo gravi, così come gli altri malati pionieri degli xenotrapianti (tutti tra i 54 e i 71 anni di età), gli è stato proposto questo tipo di trapianto a causa delle ben poche speranze di salvarsi diversamente.
L’altro caso di trapianto cardiaco sempre da maiale ancora al Medical Center dell’Università del Maryland si è verificato nel settembre del 2023 su un uomo di 58 anni che, nonostante un primo mese con dei progressi significativi in termini di recupero e funzionalità cardiaca, negli ultimi giorni il cuore di suino ha mostrato segni di rigetto.
Dal primo trapianto di rene concluso con successo da J. Murray, le liste di pazienti in attesa risultano essere ancora con molti di questi che purtroppo non avranno la possibilità di sottoporsi all’intervento. Gli xenotrapianti, quindi, potrebbero essere la soluzione alla mancanza di organi per trapianti, riuscendo ad ottenere l’indipendenza dai donatori di organi umani e contribuendo a raggiungere una qualche forma di equità sanitaria.
Se si escludono le prove precliniche, fatte su pazienti in stato di morte cerebrale trapiantati a scopo di ricerca, finora risultano essere cinque gli esseri umani che hanno ricevuto un organo animale geneticamente corretto nella speranza di scongiurare il rischio di rigetto. Questi casi dimostrano che almeno a breve termine gli organi provenienti dai suini sono sicuri e funzionano ad esempio come i reni umani anche se il tempo dovrà confermare l’effettiva efficacia e sopravvivenza dello xenotrapianto. I risultati, oltre a non rappresentare la conferma di un successo assoluto non permettono però di archiviare tutte le implicazioni etiche e morali dell’utilizzo di animali a questo scopo, che resta ancora un argomento di discussione e che certamente lo diventerà sempre di più nel momento in cui si potrà utilizzare questo approccio su scala più ampia.
Trapianti di organi suini senza necessità di immunosoppressione?
La razza di maiali in miniatura dello Yucatan è stata quella specificamente selezionata come donatore ideale e, in prospettiva, eGenesis ha in preventivo la missione di sviluppare un organo compatibile con l’uomo che possa evitare l’immunosoppressione cioè produrre organi di donatori suini che non richiedano l’immunosoppressione. Questo sta a significare che i pazienti sottoposti a trapianto non dovranno più seguire un regime di farmaci che sopprimono il sistema immunitario per prevenire il rigetto e ciò richiederà una manipolazione genetica aggiuntiva, ma per far questo occorrerà la necessità di ulteriori dati umani per aiutare a definire l’aspetto dell’ingegneria genetica.
Altre innovazioni scientifico – tecnologiche
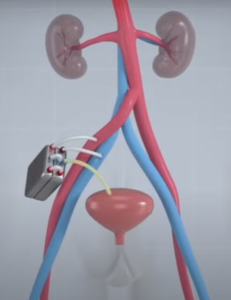
In questi ultimi anni, diverse tecnologie, in fase di studio, guardano alla creazione di reni artificiali Tuttavia, nessuna opzione è risultata, ancora, pronta per essere utilizzata sugli esseri umani nonostante si stia cercando di puntare ad individuare una soluzione innovativa. Occorre considerare che parte della mancanza di progressi nella progettazione di reni artificiali è dovuta, in particolar modo, alla complessità del lavoro che un organo come il rene deve svolgere.
Ad esempio, un cuore artificiale, per quanto complesso, è di per sé una pompa ma il rene non si occupa solo di eliminare prodotti di scarto ma è anche responsabile della produzione di eritropoietina, la cui funzione principale è la regolazione dell’eritropoiesi e dell’enzima proteolitico renina che regola sia la pressione sanguigna che la trasformazione della vitamina D nella sua forma attiva. Queste funzioni così diverse sono difficili da ricreare in un organo artificiale. Ma un altro problema è rappresentato anche dalla mancanza di strategie e tecnologie in grado di gestire il processo in sicurezza.
Attualmente si sta anche cercando di accelerare lo sviluppo di dispositivi bionici indossabili o impiantabili che potrebbero permettere di effettuare il filtraggio del sangue ovunque e in qualsiasi momento, con un notevole miglioramento della qualità di vita delle persone. Due dispositivi artificiali indossabili per la dialisi, in fase di sviluppo, sono l’Ambulatory Kidney to Improve Vitality (AKTIV) sviluppato dall’Università di Washington e il Neokidney sviluppato dalla Dutch Kidney Foundation, un ente europeo molto attivo in questo ambito. I passi da fare per raggiungere il traguardo sono ancora tanti, in quanto per la rimozione delle tossine è richiesto un volume notevole di dialisato, il liquido infuso nell’organismo in grado di assorbire le scorie che normalmente sono filtrate dai reni.
Per quanto riguarda i reni bioartificiali impiantabili, se trapiantati nel corpo umano, potrebbero rappresentare una vera e propria unità di filtrazione del sangue con cellule renali umane restando attivi per molti anni come accade per il trapianto classico. Le cellule utilizzate nel dispositivo verrebbero coltivate a partire da cellule del paziente, evitando così il rigetto e l’assunzione di immunosoppressori. L’ostacolo da superare sarebbe rappresentato dal mantenimento del dispositivo a lungo termine. Attualmente il progetto più noto è quello del Kidney Project sviluppato dall’Università della California, San Francisco, che consente il trattamento continuo del sangue e il convogliamento dei rifiuti verso la vescica, garantendo al contempo la libertà di movimento.
Un’ulteriore spinta alla ricerca di ricerca è fornita anche dallo sviluppo di mini – organi artificiali, facendo riferimento all’Anatomia dei cetacei, la quale suggerisce che tanti piccoli reni possono funzionare come due reni grandi ma con un vantaggio: sono più piccoli da produrre in laboratorio. Un team della Keck School Medicine della University of Southern California (USC), Stati Uniti, grazie ad un finanziamento dalla Kidney Innovation Accelerator (KidneyX) una partnership pubblico – privata tra lo US Department of Health and Human Services e l’American Society of Nephrology, si accinge alla realizzazione questi mini-reni artificiali a partire da cellule staminali umane.
La creazione di tutti questi dispositivi che possono essere indossabili, impiantabili, bioingegnerizzati, sviluppati come xenotrapianto o organo chimera, rappresentano approcci tecnologici di grande interesse anche se i passi da fare sono ancora tanti.
Bibliografia:
- Bhishagratna K.K. (1866) “The Sushruta Samita“, English Translation of the original Sanscript Text, XI ,Varanasi, India The Chowhamba Snskrit Seies Office
- Zimmerman KW, Fracchia C, de Jong JL, Santing C “One Leg in the Grave Revisited: The Miracle of the Transplantation of the Black Leg by the Saints Cosmas and Damian” Groningen, Barkhuis Ed. 2013.
- Tagliacozzi Gaspare (1545-1599). “De curtorum chirurgia per insitionem, libri duo“. Venezia, Gaspare Bindoni, 1597.
- Landsteiner K.& Wiener A. (1941) “Studies on an agglutinogen (Rh) in human blood reacting with anti Rhesus sera and with human isoantibodies” J Exp Med 74(4):309 -320
- Androutsos G, Vladimiros L, Diamantis A (2007) “John Hunter (1728-1793): founder of scientific surgery and precursor of oncology” Journal of B.U.ON. : Official Journal of the Balkan Union of Oncology 12(3) : 421-427
- Shklar G (2008) “John Hunter as an oral pathologist” J Hist Dent Spring 56(1): 31 – 34
- Armitage W.J., Tullo A.B. & Larkin D.F.P. (2006) “The first successful full‐thickness corneal transplant: a commentary on Eduard Zirm’s landmark paper of 1906” Br J Ophthalmol 90(10): 1222–1223.
- Timio M, Gentili S (1981) [Bottini and Lister: protagonists in the discovery of surgical antisepsis] Med Secoli 18(3):289-305.
- Carrel A (1902) “La techinique operatoire des anastomoses vasculaires et la transplantation des visceres” Lyon Med 98: 859 – 884
- Jaboulay M, Briau E (1896) “Recherches expérimentales sur la suture et la greffe arterielles“. Lyon Méd 81; 97-99.
- Jaboulay M (1906) “Greffe de reins au pli du coude par sutures artérielles et veineuses“. Bull Lyon Méd 107; 1107: 575-577.
- Payr E. (1901) “Weitere Mitteilungen über verwendung des Magnesiums bei der Naht der Blutgefasse“ Archiv f Klin Chirurg 64: 726-740.
- Guthrie CC “Blood vessel surgery and its applications“. New York, Longmans Green, 1912.
- Murphy J.B. (1914) “Factors of resistance to heteroplastic tissue-graftings. III. Studies in tissue specificity“. J Exp Med19: 513–522-
- Murphy J.B. (1914) “Heteroplastic tissue grafting effected through Roentgen-ray lymphoid destruction“. JAMA 62: 1459
- Lindbergh CA (1978). “Autobiography of values“, p. 32 Harcourt Brace Jovanovich, New York
- Belzer RO & Southard JH (1988) “Principles of solid – organ preservation by cold storage Transplantation” 45(4): 673 – 676
- Menasche P, Termignon JL, Pradier F, et al. (1994) Experimental evaluation of Celsior, a new heart preservation solution. Eur J Cardiothorac Surg. 8(4):207- 213.
- Wittwer T, Wahlers T, Cornelius JF et al, (1999) “Celsior solution for improvement of currently used clinical standards of lung preservation in an ex vivo rat model” Eur J Cardiothorac Surg 15(5) : 667 – 671
- Lama C, Rafecas A, Figueras J et al. ( 2002) “Comparative study of Celsior and Belzer solutions for hepatic graft preservation: preliminary results” Transplant Proc 34(1): 54- 55
- Han Z, Rao JS, Gangwar L et al (2023) “Vitrification and nanowarming enable long-term organ cryopreservation and life-sustaining kidney transplantation in a rat model” Nature Communications 14,3407.
- Ullmann E. (1902) “Experimentelle Nierentransplantation“. Wien Klin Wschr 15: 281-282
- Unger E (1907) “Űber Nierentransplantationen“. Berl Klin Wschr 47: 1057 -1060
- Schőne G. “Die heteroplastiche und homoőplastische transplantation“. Berlin, Springer, 1912.
- Snell G.D. (1948) “Method for the study of histocompatibility genes” J. Genet 49 : 87 -103
- Gorer P. (1937) “The genetic and antigenic basis of tumour transplantation“. J. Pathol Bacteriol 44 : 691 – 697
- Snell G,D, ,Cherry M., Demant P. (1971) “Evidence that the H-2 private specificities can be arranged in two mutually exclusive systems possibly homogeneous with the two subsystems of HLA“. Transplant Proc 3: 183 – 186
- Medawar P.B. (1958) “The immunology of transplantation“. In Harvey Lecture Series, 1956–1957, Vol. 52, pp. 144–176 Academic Press, New York
- Dausset J (1958) “Isoleuco-anticorps“. Acta Haematol 20: 156–166
- van Rood JJ, Eernisses JG, van Leeuwen A (1958). “Leucocyte antibodies in sera from pregnant women“. Nature 181: 1735–1736
- Payne R (1957) “Leukocyte agglutination in human sera: Correlation between blood transfusions and their development“. JAMA 99: 587–606
- Terasaki P, Mc Clelland J.D. ( 1964) “Microdroplet assay of human serum cytotoxins” Nature 204 : 998 – 1000
- Thomas E.D., Storb R,, Fefer A. et al. ( 1972) “Aplastic anemia treated with marrow transplantation” Lancet 1: 284 – 289
- Matevossian E, Kern H, Huser N et al (2009) “Surgeon Yuri Voronoy (1895–1961) – a pioneer in the history of clinical transplantation: in Memoriam at the 75th Anniversary of the First Human Kidney Transplantation.” Transpl Int 22(12):1132-9
- Owen R.D. (1945) “Immunogenetic consequences of vascular anastomoses between bovine twins“. Science 102: 400– 440
- Vienken J, Klinkmann H, Rakhorst G (2009) “Inventions can’t wait: a tribute to William Johan Kolff” Int Artif Organs 32(4) : 191 – 198
- Lawler RH, West JW, McNulty PH, Clancey EJ, Murphy RP (1951) “Homotransplantation of the kidney in the human “. JAMA 147: 45-46.
- Küss R, Teinturier J, Milliez P (1951) “Quelques essais de greffes de rein chez l’homme”. Mém Acad Churg 77: 755-764.
- Hume DM, Merrill JP, Miller BF, Thorn GW (1955) “Experiences with homologous transplantation in the human. Report of nine cases“. J Clin Invest 34: 327-382.
- Murray GDW, Holden R (1954) “Transplantation of kidneys, experimentally and in human cases“. Amer J Surg 87: 508- 515
- Main JM, Prehn RT (1955). “Successful skin homografts after the administration of high dosage x radiation and homologous bone marrow“. J Natl Cancer Inst 15: 1023–1029
- Starzl TE, Groth CG, Brettschneider L et al. (1967). “Orthotopic transplantation of the human liver“. Ann Surg 168: 392–415
- Hardy J.D. ( 1999) “The first lung transplant in man (1963) and the first heart tranplant in man (1964)” . Transplant Proc 31 (1-2) :25-29
- Kelly W.D., Lillehei R.C. , Merkel F.K. et al. (1967) “Allotransplantation of the pancreas and duodenum along with the kidney in diabetic nephropathy“, Surgery 61(6): 827 -83
- Barnard C.N. (1967) “The operation. A human cardiac transplant: an interim report of a successful operation performed at Groote Schuur Hospital, Cape Town S. Afr.” Med J 41(48) :1271 – 1274.
- Keith Reemtsma et al, (1964) “Renal Heterotransplantation in Man” Ann Surg. 160(3): 384–408.
- Kushner T, Belliotti R (1985) “Baby Fae: a beastly business” J Med Ethics 11(4):178-83
- deVries W.C., Anderson J.L., Joyce L.D. et al. (1984) “Clinical use of the total articifial heart“. N.Engl. J Med 310: 273 -278
- Yang L, Guell H, Niu D et al (2015) “Genome – wide inactivation of porcine endogenous Retroviruses (PERVs)” Science 350(6264):1101 -1104
- Borel JF, Feurer C, Gubler HU, Stahelin H 1976. “Biological effects of cyclosporin A: A new antilymphocytic agent“. Agents Actions 6: 468–475
- Doudna J.A. & Charpentier E. ( 2014) “Genome editing: The new frontier of genome engineering with CRISPR – Cas 9“. Science Nov 298, 346
- Montgomery RA, Stern JM, Lonze BE et al. (2022) “Results of Two Cases of Pig-to-Human Kidney Xenotransplantation“ N Engl J Med. 386(20) :1889 -1898
- Locke JE, Kumar V, Anderson D et al (2023) “Normal Graft Fubction After Pig-to-Human Kidney xenotransplatation” JAMA Sur 158(10) : 1106-1108
- Anand RP, Layer JV, Heja D et al (2023) “Design and testing of a humanized porcine donor for xenotransplantation” Nature 622: 393- 401
- Mohiuddin MM, Singh AK, Scobie L et al (2023) “Graft dysfunction in compassionate use of genetically engineered pig-to-human cardiac xenotransplantation: a case report“ Lancet 402(10399) :397-410
- Kozlov M (2023) “Monkey survivesfor two years after gene edited pig kidney transplant” Nature 622: 437 -438
- Barrangou R (2024) “CRISPR Pigs Portend a New Era of Xenotransplantation” CRISPR 7(2):71
- Kim EJ, Chen C, Gologorsky R et al (2023) “Feasibility of an implantable bioreactor for renal cell therapy using silicon nanopore membranes“ Nature Communications 14 : 4890
- Himmelfarb J & Ratner B (2020) “Wearable artificial kidney: problems, progress and prospects” Nat Rev Nephrol 16(10): 558-559
