Una rassegna sui trattamenti farmacologici del COVID-19 ai primi di aprile 2020
La pandemia globale della nuova malattia del coronavirus 2019 (COVID-19), causata dal coronavirus della sindrome respiratoria acuta grave (SARS-CoV-2), è iniziata a Wuhan, in Cina, nel dicembre 2019 e da allora si è diffusa in tutto il mondo. Al 5 aprile 2020, ci sono stati oltre 1,2 milioni di casi segnalati e 69000 decessi in oltre 200 paesi. Questo nuovo “Betacoronavirus” è simile alla coronavirus della “Sindrome Respiratoria Acuta Grave” (SARS-CoV) ed al coronavirus della “Sindrome Respiratoria del Medio Oriente” (MERS-CoV); in base alla sua vicinanza genetica, probabilmente ha avuto origine da coronavirus derivati da pipistrelli con diffusione attraverso un mammifero ospite sconosciuto nell’uomo.
Il genoma virale di SARS-CoV-2 è stato rapidamente sequenziato per consentire test diagnostici, localizzazione epidemiologica e sviluppo di prevenzione e strategie terapeutiche. Attualmente, non ci sono prove dagli “studi clinici randomizzati” (RCT) che qualsiasi potenziale terapia migliora i risultati in pazienti con COVID-19 sospetti o confermati. Non esistono dati di studi clinici a supporto di alcuna terapia profilattica. Sono in corso oltre 300 studi clinici attivi sul trattamento. Questa revisione riassume le prove attuali relative ai principali trattamenti proposti, riproposti o sperimentali per il COVID-19, e fornisce un riassunto delle attuali esperienze cliniche e linee guida per il trattamento di questa nuova epidemia di coronavirus.
Metodi
Una revisione della letteratura è stata eseguita utilizzando “PubMed” per identificare articoli pertinenti in lingua inglese pubblicati fino al 25 marzo 2020. I termini di ricerca includevano coronavirus, sindrome respiratoria acuta grave coronavirus 2, 2019-nCoV, SARS-CoV-2, SARS-CoV, MERS-CoV e COVID-19 in combinazione con trattamento e farmacologia. La ricerca ha prodotto 1315 articoli in totale. A causa della mancanza di RCT, gli autori hanno anche incluso casi clinici, serie di casi e articoli di revisione. Gli autori hanno esaminato indipendentemente i titoli e gli abstract per l’inclusione. Ulteriori articoli pertinenti sono stati identificati dalla revisione delle citazioni citate. Gli studi clinici attivi sono stati identificati usando il termine di ricerca della “malattia da infezione da coronavirus” su ClinicalTrials.gov e l’indice degli studi sulla nuova polmonite da coronavirus nel “registro di sperimentazione clinica cinese“.
SARS-CoV-2: obiettivi virologici e farmacologici
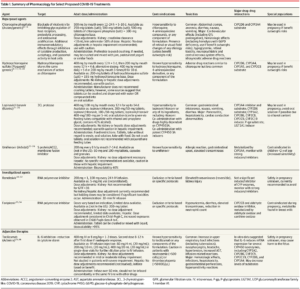
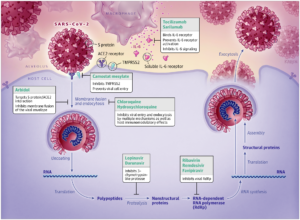
Il SARS-CoV-2, un virus incapsulato a singolo filamento di RNA, ‘colpisce’ le cellule attraverso la “proteina virale strutturale spike” (S) che si lega al recettore dell’enzima di conversione dell’angiotensina 2 (ACE2). Dopo il legame con i recettori, la particella virale utilizza i recettori e gli endosomi delle cellule ospiti per entrare nelle cellule. Una “serin proteasi transmembrana di tipo host 2“, TMPRSS2, facilita l’ingresso delle cellule attraverso la proteina S. Una volta all’interno della cellula, vengono sintetizzate le poliproteine virali che codificano per il complesso replicasi-trascrittasi. Il virus quindi sintetizza l’RNA attraverso la sua RNA polimerasi RNA-dipendente. Le proteine strutturali vengono sintetizzate portando al completamento dell’assemblaggio ed al rilascio di particelle virali. Queste fasi del ciclo di vita virale forniscono potenziali bersagli per la terapia farmacologica (Figura). Promettenti bersagli farmacologici includono proteine non strutturali (ad esempio: “proteasi simili alla 3-chimotripsina“, “proteasi simili alla papaina“, “RNA polimerasi RNA-dipendente“), che condividono l’omologia con altri nuovi coronavirus (nCoVs). Ulteriori bersagli farmacologici includono percorsi di ingresso virale e di regolazione immunitaria. La Tabella 1 riassume il meccanismo d’azione ed i principali parametri farmacologici dei trattamenti proposti o delle terapie aggiuntive per il COVID-19.
Trial clinici in corso
I termini di ricerca “COVID” o “coronavirus” o “SARS-COV-2” su ClinicalTrials.gov hanno prodotto 351 studi attivi, con 291 studi specifici per COVID-19 al 2 aprile 2020. Di questi 291 studi, circa 109 studi (inclusi quelli non ancora in reclutamento, in reclutamento, attivo o completato) includevano la terapia farmacologica per il trattamento del COVID-19 in pazienti adulti. Di questi 109 studi, 82 sono studi interventistici, con 29 studi controllati con placebo.
Per descrizione degli studi, ci sono 11 studi di fase 4, 36 di fase 3, 36 di fase 2 e 4 di fase 1. Ventidue trial non sono stati classificati per fase di studio o non erano applicabili.
Revisione dei farmaci riproposti selezionati
Gli agenti precedentemente utilizzati per trattare la SARS e la MERS sono potenziali candidati per il trattamento di COVID-19. Vari agenti con apparente attività in vitro contro SARS-CoV e MERS-CoV sono stati usati durante gli episodi di SARS e MERS, con efficacia incoerente. Le meta-analisi degli studi sul trattamento della SARS e del MERS non hanno riscontrato chiari benefici di alcun regime specifico. Di seguito, vengono esaminate l’attività in vitro e le esperienze cliniche pubblicate di alcuni dei farmaci più promettenti riproposti per il COVID-19.
Clorochina eD idrossiclorochina
La clorochina e l’idrossiclorochina hanno una lunga storia nella prevenzione e nel trattamento della malaria e nel trattamento delle malattie infiammatorie croniche tra cui il ‘lupus eritematoso sistemico‘ (LES) e ‘l’artrite reumatoide‘ (RA). La clorochina e l’idrossiclorochina sembrano bloccare l’ingresso virale nelle cellule inibendo la glicosilazione dei recettori ospiti, l’elaborazione proteolitica e l’acidificazione endosomiale. Questi agenti hanno anche effetti immunomodulatori, attraverso l’attenuazione della produzione di citochine e l’inibizione dell’autofagia e dell’attività lisosomiale nelle cellule ospiti. L’idrossiclorochina ha attività in vitro con un ‘EC50’ inferiore per SARS-CoV-2 rispetto alla clorochina dopo 24 ore di crescita (idrossiclorochina: EC50 = 6,14 μM e clorochina: EC50 = 23,90 μM).
Non esistono prove di alta qualità sull’efficacia del trattamento con clorochina / idrossiclorochina sulla SARS o MERS.
Una nota informativa dalla Cina ha riferito che la clorochina è stata utilizzata con successo per trattare una serie di oltre 100 casi di COVID-19 che hanno portato a risultati radiologici migliorati, maggiore ‘clearance virale‘ e riduzione della progressione della malattia. Tuttavia, i dati di progettazione ed i risultati della sperimentazione clinica non hanno ancora stato presentato o pubblicato per la “peer review“, impedendo la convalida di tali affermazioni.
LO STUDIO FRANCESE SULL’IDROSSICLOROCHINA
 Un recente studio francese non randomizzato su 36 pazienti (20 nel gruppo idrossiclorochina e 16 nel gruppo controllo) ha riportato un miglioramento della clearance virologica con idrossiclorochina, 200 mg, per via orale ogni 8 ore rispetto ai pazienti di controllo che ricevono cure standard di supporto. La clearance virologica al giorno 6, misurata con tamponi rinofaringei, è stata del 70% (14/20) contro il 12,5% (2/16) per i gruppi idrossiclorochina e controllo, rispettivamente (P = 0,001). Gli autori hanno anche riferito che l’aggiunta di azitromicina all’idrossiclorochina in 6 pazienti ha comportato una clearance virale numericamente superiore (6/6, 100%) rispetto alla monoterapia con idrossiclorochina (8/14, 57%). Nonostante questi risultati promettenti, questo studio presentava diversi limiti importanti: una piccola dimensione del campione (solo 20 nel braccio di intervento e solo 6 trattati con idrossiclorochina e azitromicina); la rimozione di 6 pazienti nel gruppo idrossiclorochina dall’analisi a causa della cessazione anticipata del trattamento derivante da malattia critica o intolleranza ai farmaci; carichi virali basali variabili tra monoterapia con idrossiclorochina e gruppi di terapia combinata; e nessun risultato clinico o di sicurezza riportato. Queste limitazioni associate a preoccupazioni di cardiotossicità additiva con terapia di combinazione non supportano l’adozione di questo regime senza ulteriori studi.
Un recente studio francese non randomizzato su 36 pazienti (20 nel gruppo idrossiclorochina e 16 nel gruppo controllo) ha riportato un miglioramento della clearance virologica con idrossiclorochina, 200 mg, per via orale ogni 8 ore rispetto ai pazienti di controllo che ricevono cure standard di supporto. La clearance virologica al giorno 6, misurata con tamponi rinofaringei, è stata del 70% (14/20) contro il 12,5% (2/16) per i gruppi idrossiclorochina e controllo, rispettivamente (P = 0,001). Gli autori hanno anche riferito che l’aggiunta di azitromicina all’idrossiclorochina in 6 pazienti ha comportato una clearance virale numericamente superiore (6/6, 100%) rispetto alla monoterapia con idrossiclorochina (8/14, 57%). Nonostante questi risultati promettenti, questo studio presentava diversi limiti importanti: una piccola dimensione del campione (solo 20 nel braccio di intervento e solo 6 trattati con idrossiclorochina e azitromicina); la rimozione di 6 pazienti nel gruppo idrossiclorochina dall’analisi a causa della cessazione anticipata del trattamento derivante da malattia critica o intolleranza ai farmaci; carichi virali basali variabili tra monoterapia con idrossiclorochina e gruppi di terapia combinata; e nessun risultato clinico o di sicurezza riportato. Queste limitazioni associate a preoccupazioni di cardiotossicità additiva con terapia di combinazione non supportano l’adozione di questo regime senza ulteriori studi.
STUDIO CINESE SULL’IDROSSICLOROCHINA
Un altro studio prospettico di 30 pazienti in Cina ha randomizzato i pazienti a idrossiclorochina, 400 mg, ogni giorno per 5 giorni più standard di terapia (terapia di supporto, interferone e altri antivirali) o terapia standard da sola in un modo 1: 1; non vi era alcuna differenza nei risultati virologici. Al giorno 7, la clearance virologica era simile, con una clearance dell’86,7% vs 93,3% per l’idrossiclorochina più il gruppo di cure standard e il gruppo di cure standard, rispettivamente (P> 0,05).
altri studi su clorochina ed IDROSSICLOROCHINA
Attualmente, ci sono diversi RCT sia sulla clorochina che idrossiclorochina ed il loro ruolo nel trattamento COVID-19. Sono previsti o arruolati studi sulla profilassi della clorochina negli operatori sanitari (“NCT04303507“) e l’idrossiclorochina per la profilassi post-esposizione dopo esposizioni ad alto rischio (“NCT04308668“).
Il dosaggio della clorochina per il trattamento di COVID-19 è consistito in 500 mg per via orale una o due volte al giorno. Tuttavia, esiste una scarsità di dati sulla dose ottimale per garantire la sicurezza e l’efficacia della clorochina. Le raccomandazioni di dosaggio di idrossiclorochina per il LES sono generalmente di 400 mg per via orale ogni giorno. Tuttavia, uno studio di modellistica farmacocinetica basato ha raccomandato che il regime di dosaggio ottimale per idrossiclorochina nel trattamento COVID-19 sia una dose di carico di 400 mg due volte al giorno per 1 giorno seguito da 200 mg due volte al giorno. Alternativamente, vengono formulate diverse raccomandazioni per la dose giornaliera totale di 600 mg in base alla sicurezza e all’esperienza clinica per la “malattia di Whipple“. Sono necessari ulteriori studi per delineare la dose ottimale per COVID-19.
EFFETTI COLLATERALI DI CLOROCHINA ED IDROSSICLOROCHINA
La clorochina e l’idrossiclorochina sono relativamente ben tollerate, come dimostrato da una vasta esperienza in pazienti con LES e malaria. Tuttavia, entrambi gli agenti possono causare effetti avversi rari e gravi (<10%), tra cui prolungamento elettrocardiografico dell’intervallo QT, ipoglicemia, effetti neuropsichiatrici e retinopatia. L’elettrocardiogramma basale per valutare il QTc prolungato è consigliabile prima e dopo l’inizio del trattamento con questi farmaci a causa del rischio di aritmie, specialmente nei pazienti critici e in quelli che assumono concomitanti farmaci prolunganti l’intervallo QT come azitromicina e fluorochinoloni. Non sono stati riportati effetti avversi significativi per la clorochina alle dosi e durate proposte per COVID-19.
Lopinavir / Ritonavir ed altri antiretrovirali
 Lopinavir / ritonavir, un farmaco approvato dalla “US Food and Drug Administration” (FDA) in combinazione orale per il trattamento dell’HIV, ha dimostrato l’attività in vitro contro altri nuovi coronavirus attraverso l’inibizione della proteasi simile alla 3-chimotripsina. Non esistono alcuni dati in vitro pubblicati sulla SARS-CoV-2 per lopinavir / ritonavir. Una revisione sistematica di lopinavir / ritonavir per il trattamento della SARS e MERS ha trovato studi disponibili limitati, con la maggior parte di questi che hanno indagato sulla SARS. Gli studi clinici sulla SARS sono stati associati a tassi di mortalità e intubazione ridotti, ma la loro natura retrospettiva e osservativa impedisce conclusioni definitive. I tempi di somministrazione durante la fase iniziale di picco della replicazione virale (7-10 giorni iniziali) sembrano essere importanti perché l’inizio ritardato della terapia con lopinavir / ritonavir non ha avuto effetti sugli esiti clinici.
Lopinavir / ritonavir, un farmaco approvato dalla “US Food and Drug Administration” (FDA) in combinazione orale per il trattamento dell’HIV, ha dimostrato l’attività in vitro contro altri nuovi coronavirus attraverso l’inibizione della proteasi simile alla 3-chimotripsina. Non esistono alcuni dati in vitro pubblicati sulla SARS-CoV-2 per lopinavir / ritonavir. Una revisione sistematica di lopinavir / ritonavir per il trattamento della SARS e MERS ha trovato studi disponibili limitati, con la maggior parte di questi che hanno indagato sulla SARS. Gli studi clinici sulla SARS sono stati associati a tassi di mortalità e intubazione ridotti, ma la loro natura retrospettiva e osservativa impedisce conclusioni definitive. I tempi di somministrazione durante la fase iniziale di picco della replicazione virale (7-10 giorni iniziali) sembrano essere importanti perché l’inizio ritardato della terapia con lopinavir / ritonavir non ha avuto effetti sugli esiti clinici.
uno studio cinese sul kaletra
I primi report riguardo all’utilizzo di lopinavir / ritonavir per il trattamento di COVID-19 sono principalmente casi clinici e piccoli studi retrospettivi non randomizzati di coorte, il che rende difficile accertare l’effetto del trattamento diretto di lopinavir / ritonavir. Più recentemente, Bin Cao e colleghi hanno riportato i risultati di un RCT in ‘open-label’ confrontando l’efficacia di lopinavir / ritonavir rispetto alle cure standard in 199 pazienti con COVID-19. È importante sottolineare che il tempo mediano dall’insorgenza dei sintomi alla randomizzazione è stato di 13 giorni (intervallo interquartile [IQR], 11-16), senza differenze tra i gruppi. L’outcome primario di tempo al miglioramento clinico definito da un miglioramento di 2 punti su una scala ordinale di 7 categorie o dimissione ospedaliera era simile in entrambi i gruppi (16 giorni [IQR, 13-17] contro 16 giorni [IQR, 15-17]; ‘hazard ratio’ [HR], 1,31 [IC 95%, 0,95-1,85]; P = .09). Inoltre, non sono state osservate differenze significative nella clearance virale o nei tassi di mortalità a 28 giorni (19,2% vs 25,0%; differenza assoluta, -5,8% [IC 95%, da -17,3% a 5,7%]). Sebbene l’inizio ritardato del trattamento possa parzialmente spiegare l’inefficacia di lopinavir / ritonavir per il trattamento di COVID-19, un’analisi per sottogruppi non ha trovato tempi più brevi per il miglioramento clinico per i pazienti che hanno ricevuto terapia entro 12 giorni (HR, 1,25 [IC al 95%, 0,77-2,05 23) Sebbene siano in corso ulteriori RCT di lopinavir / ritonavir, i dati attuali suggeriscono un ruolo limitato di lopinavir / ritonavir nel trattamento con COVID-19.
regime terapeutico del kaletra
Il regime di dosaggio di lopinavir / ritonavir più comunemente usato e studiato per il trattamento con COVID-19 è di 400 mg / 100 mg due volte al giorno per un massimo di 14 giorni. Date le significative interazioni farmacologiche, è necessario un attento esame dei farmaci concomitanti ed il monitoraggio se questo farmaco viene utilizzato (come mostra la Tabella 1). Gli effetti collaterali di lopinavir / ritonavir comprendono disturbi gastrointestinali come nausea e diarrea (fino al 28%) ed epatotossicità (2% -10%). In pazienti con COVID-19, questi effetti avversi possono essere aggravati dalla terapia concomitante o dall’infezione virale, poiché circa il 20-30% dei pazienti ha transaminasi elevate alla presentazione del COVID-19. Un recente RCT ha mostrato che circa il 50% dei pazienti in terapia con “lopinavir / ritonavir” ha manifestato un effetto avverso e il 14% dei pazienti ha interrotto la terapia a causa di effetti avversi gastrointestinali. L’incremento indotto delle transaminasi è particolarmente preoccupante perché può esacerbare il danno epatico derivante da COVID-19. È importante sottolineare che gli aumenti dell’alanina-aminotransferasi (ALT) sono un criterio di esclusione in numerosi studi investigativi COVID-19, il che significa che l’epatotossicità indotta da “lopinavir / ritonavir” potrebbe limitare la capacità dei pazienti di accedere ad altri farmaci.
ALTRI ANTIRETROVIRALI
Altri antiretrovirali, inclusi gli “inibitori della proteasi” e gli “inibitori del trasferimento di filamenti di integrasi“, sono stati identificati dallo screening dell’attività enzimatica con attività SARS-CoV-2. I modelli cellulari in vitro hanno dimostrato l’attività di darunavir contro SARS-CoV-2. Non ci sono dati clinici sull’uomo in COVID-19 con questi farmaci, ma è in corso un RCT di “darunavir / cobicistat” in Cina.
Ribavirina
 La ribavirina, un analogo della guanina, inibisce l’RNA polimerasi virale dipendente dall’RNA. La sua attività contro altri nCoV lo rende candidato per il trattamento COVID-19. Tuttavia, la sua attività in vitro contro SARS-CoV era limitata e richiedeva alte concentrazioni per inibire la replicazione virale, richiedendo alte dosi (cioè da 1,2 grammi a 2,4 grammi per via orale ogni 8 ore) e terapia di associazione. Pazienti avevano ricevuto la somministrazione endovenosa o enterale in studi precedenti. Non esistono evidenze sulla ribavirina per inalazione nel trattamento di nCoV, mentre dati con il “virus respiratorio sinciziale” suggeriscono che la somministrazione per inalazione non offre alcun beneficio rispetto alla somministrazione per via enterale o endovenosa.
La ribavirina, un analogo della guanina, inibisce l’RNA polimerasi virale dipendente dall’RNA. La sua attività contro altri nCoV lo rende candidato per il trattamento COVID-19. Tuttavia, la sua attività in vitro contro SARS-CoV era limitata e richiedeva alte concentrazioni per inibire la replicazione virale, richiedendo alte dosi (cioè da 1,2 grammi a 2,4 grammi per via orale ogni 8 ore) e terapia di associazione. Pazienti avevano ricevuto la somministrazione endovenosa o enterale in studi precedenti. Non esistono evidenze sulla ribavirina per inalazione nel trattamento di nCoV, mentre dati con il “virus respiratorio sinciziale” suggeriscono che la somministrazione per inalazione non offre alcun beneficio rispetto alla somministrazione per via enterale o endovenosa.
Una revisione sistematica dell’esperienza clinica con ribavirina per il trattamento della SARS ha rivelato risultati inconcludenti in 26 dei 30 studi esaminati, con 4 studi che dimostrano la possibilità di danni causati da effetti avversi tra cui tossicità ematologica ed epatica. Nel trattamento della MERS, la ribavirina, generalmente in combinazione con interferoni, non ha riscontrato alcun effetto visibile sugli aspetti clinici o sulla clearance virale. Una scarsità di dati clinici con la ribavirina sul SARS-CoV-2 significa che il suo ruolo terapeutico deve essere estrapolato da altri dati nCoV.
effetti collaterali della ribavirina
La ribavirina provoca grave tossicità ematologica dose-dipendente. Le alte dosi utilizzate negli studi sulla SARS hanno provocato anemia emolitica in oltre il 60% dei pazienti. Analoghi problemi di sicurezza sono stati osservati nel più grande studio osservazionale sul MERS, con circa il 40% dei pazienti che assumevano ribavirina più interferone che richiedono trasfusioni di sangue. Il 75% dei pazienti che assumevano ribavirina per la SARS ha manifestato aumenti delle transaminasi. La ribavirina è anche un teratogeno noto e controindicato in gravidanza.
I dati di efficacia inconcludente con ribavirina per altri nCoV e la sua sostanziale tossicità suggeriscono che ha un valore limitato per il trattamento di COVID-19. Se utilizzata, la terapia di combinazione probabilmente fornisce le migliori possibilità di efficacia clinica.
Altri antivirali
 Oseltamivir, un inibitore della neuraminidasi approvato per il trattamento dell’influenza, non ha documentato attività in vitro contro il SARS-CoV-2.
Oseltamivir, un inibitore della neuraminidasi approvato per il trattamento dell’influenza, non ha documentato attività in vitro contro il SARS-CoV-2.
L’epidemia di COVID-19 in Cina si è inizialmente verificata durante la stagione di picco dell’influenza, quindi un’ampia percentuale di pazienti ha ricevuto la terapia empirica con oseltamivir fino alla scoperta di SARS-CoV-2 come causa di COVID-19.
Molti degli studi clinici attuali includono oseltamivir nel gruppo di confronto ma non come un intervento terapeutico proposto. Questo agente non ha alcun ruolo nella gestione di COVID-19 una volta esclusa l’influenza.
Arbidol
 Umifenovir (noto anche come Arbidol) è un agente antivirale riproposto come più promettente, con un meccanismo d’azione unico mirato all’interazione sulla proteina S / ACE2 e all’inibizione della fusione della membrana dell’involucro virale. L’agente è attualmente approvato in Russia e Cina per il trattamento e profilassi dell’influenza ed è di crescente interesse per il trattamento di COVID-19 sulla base di dati in vitro che ne suggeriscono l’attività contro la SARS. La dose attuale di 200 mg per via orale ogni 8 ore per l’influenza viene studiata per il trattamento COVID-19 (NCT04260594).
Umifenovir (noto anche come Arbidol) è un agente antivirale riproposto come più promettente, con un meccanismo d’azione unico mirato all’interazione sulla proteina S / ACE2 e all’inibizione della fusione della membrana dell’involucro virale. L’agente è attualmente approvato in Russia e Cina per il trattamento e profilassi dell’influenza ed è di crescente interesse per il trattamento di COVID-19 sulla base di dati in vitro che ne suggeriscono l’attività contro la SARS. La dose attuale di 200 mg per via orale ogni 8 ore per l’influenza viene studiata per il trattamento COVID-19 (NCT04260594).
In Cina è stata descritta un’esperienza clinica limitata con umifenovir per COVID-19. Uno studio non randomizzato su 67 pazienti con COVID-19 ha mostrato che il trattamento con umifenovir per una durata mediana di 9 giorni era associato a tassi di mortalità più bassi (0% [0/36] vs 16% [5/31]) e tassi di dimissione più elevati rispetto con pazienti che non hanno ricevuto l’agente. Questi dati osservativi non possono stabilire l’efficacia di umifenovir per COVID-19, ma gli RCT in corso in Cina stanno ulteriormente valutando questo agente.
Agenti vari
 L’interferone-α e l’interferone-β sono stati studiati per nCoV, con attività dimostrativa dell’interferone-β contro MERS. La maggior parte degli studi pubblicati ha riportato risultati della terapia combinata con ribavirina e / o lopinavir / ritonavir. Simile ad altri agenti, il trattamento ritardato può limitare l’efficacia di questi agenti. Visti i dati contrastanti in vitro e sugli animali, e l’assenza di studi clinici, l’uso di interferoni per il trattamento della SARS-CoV-2 non può attualmente essere raccomandato. Le attuali linee guida cinesi elencano gli interferoni come alternativa alla terapia di combinazione.
L’interferone-α e l’interferone-β sono stati studiati per nCoV, con attività dimostrativa dell’interferone-β contro MERS. La maggior parte degli studi pubblicati ha riportato risultati della terapia combinata con ribavirina e / o lopinavir / ritonavir. Simile ad altri agenti, il trattamento ritardato può limitare l’efficacia di questi agenti. Visti i dati contrastanti in vitro e sugli animali, e l’assenza di studi clinici, l’uso di interferoni per il trattamento della SARS-CoV-2 non può attualmente essere raccomandato. Le attuali linee guida cinesi elencano gli interferoni come alternativa alla terapia di combinazione.
Diversi altri agenti immunomodulatori usati tradizionalmente per indicazioni non infettive dimostrano attività in vitro o possiedono meccanismi presunti per inibire la SARS-CoV-2; tra questi ci sono baricitinib, imatinib, dasatinib e ciclosporina. Tuttavia, non esistono dati animali o umani per raccomandarne l’uso per COVID-19, e resta da vedere se conferiscono protezione ai pazienti che li stanno già assumendo per altre indicazioni.
NITAZOXANIDE E CAMOSTAT MESILATO
 Il nitazoxanide, tradizionalmente un agente antielmintico, ha un’ampia attività antivirale eD un profilo di sicurezza relativamente favorevole. Il nitazoxanide ha dimostrato attività antivirale in vitro contro MERS e SARS-CoV-2. In attesa di ulteriori prove, l’attività antivirale, gli effetti immunomodulatori ed il profilo di sicurezza del nitazoxanide giustificano il suo ulteriore studio come opzione di trattamento per SARS-CoV-2.
Il nitazoxanide, tradizionalmente un agente antielmintico, ha un’ampia attività antivirale eD un profilo di sicurezza relativamente favorevole. Il nitazoxanide ha dimostrato attività antivirale in vitro contro MERS e SARS-CoV-2. In attesa di ulteriori prove, l’attività antivirale, gli effetti immunomodulatori ed il profilo di sicurezza del nitazoxanide giustificano il suo ulteriore studio come opzione di trattamento per SARS-CoV-2.
Camostat mesilato, un agente approvato in Giappone per il trattamento della pancreatite, impedisce l’ingresso delle cellule nCoV in vitro attraverso l’inibizione della serin proteasi ospite, TMPRSS2. Questo nuovo meccanismo fornisce un ulteriore obiettivo farmacologico per la ricerca futura.
SARS-CoV-2 utilizza il recettore dell’ACE2 per l’ingresso nella cellula ospite. Questa scoperta ha stimolato discussioni sul fatto che gli ACE-inibitori e / o i bloccanti del recettore dell’angiotensina possano potenzialmente curare COVID-19 o, al contrario, peggiorare la malattia. Questi farmaci aumentano i recettori dell’ACE2, che potrebbero teoricamente portare a risultati peggiori se l’entrata virale è migliorata. Al contrario, i bloccanti dei recettori dell’angiotensina potrebbero teoricamente fornire benefici clinici attraverso il blocco dei recettori ACE2. Esistono dati contrastanti in vitro per determinare se questi agenti hanno un effetto dannoso o protettivo nei pazienti con COVID-19. In attesa di ulteriori ricerche, società cliniche e linee guida pratiche raccomandano di continuare la terapia per i pazienti che già assumono questi agenti.
Revisione di farmaci sperimentali selezionati
Remdesivir
Remdesivir, formalmente noto come “GS-5734“, è un profarmaco monofosfato che subisce il metabolismo in un analogo attivo del trifosfato nucleosidico C-adenosina. L’agente è stato scoperto nel corso di un processo di screening per antimicrobici con attività contro i virus dell’RNA, come ‘Coronaviridae’ e ‘Flaviviridae’. La ricerca e lo sviluppo dell’agente hanno mostrato risultati promettenti durante il picco dell’epidemia del virus Ebola a causa della bassa EC50 e della selettività della polimerasi ospite contro il virus Ebola. Attualmente, remdesivir è una promettente potenziale terapia per COVID-19 a causa del suo ampio spettro, la potente attività in vitro contro diversi nCoV, tra cui SARS-CoV-2 con valori EC50 ed EC90 rispettivamente di 0,77 μM e 1,76 μM. Nei modelli di infezione polmonare murina con MERS-CoV, remdesivir ha prevenuto l’emorragia polmonare e ridotto i titoli virali polmonari più che gli agenti di confronto.
La sicurezza e la farmacocinetica di remdesivir sono state valutate in studi clinici di fase 1 a dose singola e multipla. Le infusioni endovenose tra 3 mg e 225 mg sono state ben tollerate senza alcuna evidenza di tossicità epatica o renale. Remdesivir ha dimostrato una farmacocinetica lineare entro questo intervallo di dose e un’emivita intracellulare superiore a 35 ore. Dopo somministrazioni a dosi multiple, si sono verificati aumenti reversibili dell’aspartato aminotransferasi e dell’alanina transaminasi. L’attuale dose in esame è una singola dose di carico da 200 mg, seguita da infusione giornaliera da 100 mg. Non sono raccomandati aggiustamenti epatici o renali in questo momento, ma l’inizio non è raccomandato nei pazienti con una velocità di filtrazione glomerulare stimata inferiore a 30 ml / min.
Il primo uso clinico di remdesivir è stato per il trattamento di Ebola; tuttavia, sono stati riportati casi clinici di successo che descrivono l’uso di remdesivir per COVID-19. Sono in corso studi clinici per valutare la sicurezza e l’attività antivirale di remdesivir in pazienti con COVID-19 da lieve a moderato o grave (NCT04292899, NCT04292730, NCT04257656, NCT04252664, NCT04280705). Di particolare importanza, il “National Institutes of Health” sta sponsorizzando uno studio adattivo, randomizzato, in doppio cieco, controllato con placebo che farà luce sull’efficacia di remdesivir rispetto alle cure di supporto (NCT04280705). Poiché i risultati degli RCT sono anticipati, l’inclusione di questo agente per il trattamento di COVID-19 può essere presa in considerazione. In particolare, remdesivir non è attualmente approvato dalla FDA e deve essere ottenuto mediante uso compassionevole (solo per bambini <18 anni e donne in gravidanza), accesso esteso o iscrizione a una sperimentazione clinica.
Favipiravir
 Favipiravir, precedentemente noto come “T-705“, è un profarmaco di un nucleotide purinico, favofiravir ribofuranosil-5′-trifosfato. L’agente attivo inibisce l’RNA polimerasi, arrestando la replicazione virale. La maggior parte dei dati preclinici di favipiravir derivano dalla sua attività sull’Influenza ed Ebola; tuttavia, l’agente ha anche dimostrato un’ampia attività contro altri virus RNA. In vitro, l’EC50 di favipiravir contro SARS-CoV-2 era 61,88 μM / L nelle “cellule Vero E6“.
Favipiravir, precedentemente noto come “T-705“, è un profarmaco di un nucleotide purinico, favofiravir ribofuranosil-5′-trifosfato. L’agente attivo inibisce l’RNA polimerasi, arrestando la replicazione virale. La maggior parte dei dati preclinici di favipiravir derivano dalla sua attività sull’Influenza ed Ebola; tuttavia, l’agente ha anche dimostrato un’ampia attività contro altri virus RNA. In vitro, l’EC50 di favipiravir contro SARS-CoV-2 era 61,88 μM / L nelle “cellule Vero E6“.
Sono stati proposti vari regimi posologici in base al tipo di indicazione infettiva. Le variazioni di dosaggio sono probabilmente dovute ai valori più bassi di favipiravir EC50 descritti contro l’influenza rispetto a Ebola e SARS-CoV-2. Per il trattamento di COVID-19, si raccomanda di prendere in considerazione dosi al limite superiore dell’intervallo di dosaggio (da 2400 mg a 3000 mg ogni 12 ore × 2 dosi) seguito da una dose di mantenimento (da 1200 mg a 1800 mg ogni 12 ore). L’emivita è di circa 5 ore. L’agente ha un profilo lieve di effetti avversi ed è complessivamente ben tollerato, sebbene il profilo degli eventi avversi per i regimi di dose più elevata sia limitato. Favipiravir è attualmente disponibile in Giappone per il trattamento dell’influenza, ma non disponibile negli Stati Uniti per uso clinico.
Sono state riportate esperienze cliniche limitate a supporto dell’uso di favipiravir per COVID-19. In uno studio prospettico, randomizzato, multicentrico, favipiravir (n = 120) è stato confrontato con Arbidol (n = 120) per il trattamento di infezioni COVID-19 moderate e gravi. Differenze nel recupero clinico al giorno 7 sono state osservate in pazienti con infezioni moderate (71,4% di favipiravir e Arbidol 55,9%, P = 0,019). Non sono state osservate differenze significative nei bracci gravi o gravi e moderati (combinati ). Questi dati supportano ulteriori indagini con RCT sull’efficacia di favipiravir per il trattamento di COVID-19.
revisione dei farmaci
Questa revisione dei farmaci proposti è per necessità selettiva. Una recente revisione completa condotta da una divisione dell’American Chemical Society ha analizzato i dati scientifici relativi agli agenti terapeutici ed ai vaccini nei coronavirus umani dal 2003, utilizzando sia letteratura pubblicata che brevetti in tutto il mondo. Questa analisi ha riportato oltre 130 brevetti e oltre 3000 potenziali piccoli candidati a farmaci molecolari con potenziale attività contro i coronavirus umani. La stessa analisi ha identificato più di 500 brevetti per agenti biologici con attività contro i coronavirus tra cui anticorpi terapeutici, citochine, terapie con RNA e vaccini. Un’altra analisi prestampata delle mappe di interazione proteina-proteina SARS-CoV-2-umana ha identificato 332 interazioni proteina-proteina ad alta confidenza, producendo 66 proteine umane candidate come farmaci o fattori ospiti bersaglio di farmaci esistenti approvati dalla FDA o farmaci sperimentali. Si spera che questa grande quantità di potenziali agenti possa fornire terapie candidate nella corsa per trovare trattamenti efficaci o strategie preventive contro COVID-19.
terapie aggiuntive
Allo stato attuale, in assenza di una terapia comprovata per SARS-CoV-2, la pietra angolare dell’assistenza per i pazienti con COVID-19 rimane la terapia di supporto, che va dalla gestione ambulatoriale sintomatica al supporto di terapia intensiva completa. Tuttavia, terapie aggiuntive che meritano una menzione speciale sono i corticosteroidi, le anti-citochine o gli agenti immunomodulatori e la terapia con immunoglobuline.
corticosteroidi
 Il razionale per l’uso dei corticosteroidi è di ridurre le risposte infiammatorie dell’ospite nei polmoni, che possono portare a lesioni polmonari acute e sindrome da distress respiratorio acuto (ARDS). Tuttavia, questo beneficio può essere compensato da effetti avversi, tra cui la clearance virale ritardata e un aumentato rischio di infezione secondaria. Sebbene l’evidenza diretta dei corticosteroidi in COVID-19 sia limitata, le revisioni degli esiti in altre polmoniti virali sono istruttive. Gli studi osservazionali in pazienti con SARS e MERS non hanno riportato associazioni di corticosteroidi con una migliore sopravvivenza, ma hanno dimostrato un’associazione con una clearance virale ritardata delle vie respiratorie e sangue e alti tassi di complicanze tra cui iperglicemia, psicosi e necrosi avascolare. Inoltre, una metanalisi del 2019 di 10 studi osservazionali con 6548 pazienti con polmonite influenzale ha rilevato che i corticosteroidi erano associati ad un aumentato rischio di mortalità (risk ratio [RR], 1,75 [IC 95%, 1,3-2,4]; P <.001) e un rischio 2 volte maggiore di infezioni secondarie (RR, 1,98 [IC 95%, 1,0-3,8]; P = 0,04 ). Sebbene l’efficacia dei corticosteroidi nell’ARDS e nello shock settico rimanga più generalmente discussa, Russell e colleghi hanno sostenuto che quelli che hanno maggiori probabilità di beneficiare dei corticosteroidi sono quelli con batteri piuttosto delle infezioni virali. Un recente studio retrospettivo su 201 pazienti con COVID-19 in Cina ha scoperto che, per coloro che hanno sviluppato ARDS, il trattamento con metilprednisolone era associato a un ridotto rischio di morte (23/50 [46%] con steroidi contro 21/34 [62% ] senza; HR, 0,38 [IC al 95%, 0,20-0,72]). Tuttavia, gli autori hanno notato che in questo studio osservazionale possono esistere pregiudizi e confusione residua tra coloro che hanno o non hanno ricevuto steroidi. Pertanto, i potenziali danni e la mancanza di comprovati benefici per i corticosteroidi mettono in guardia contro il loro uso di routine nei pazienti con COVID-19 al di fuori di un RCT a meno che non esista un’indicazione convincente concomitante, come esacerbazione cronica della malattia polmonare ostruttiva o shock refrattario.
Il razionale per l’uso dei corticosteroidi è di ridurre le risposte infiammatorie dell’ospite nei polmoni, che possono portare a lesioni polmonari acute e sindrome da distress respiratorio acuto (ARDS). Tuttavia, questo beneficio può essere compensato da effetti avversi, tra cui la clearance virale ritardata e un aumentato rischio di infezione secondaria. Sebbene l’evidenza diretta dei corticosteroidi in COVID-19 sia limitata, le revisioni degli esiti in altre polmoniti virali sono istruttive. Gli studi osservazionali in pazienti con SARS e MERS non hanno riportato associazioni di corticosteroidi con una migliore sopravvivenza, ma hanno dimostrato un’associazione con una clearance virale ritardata delle vie respiratorie e sangue e alti tassi di complicanze tra cui iperglicemia, psicosi e necrosi avascolare. Inoltre, una metanalisi del 2019 di 10 studi osservazionali con 6548 pazienti con polmonite influenzale ha rilevato che i corticosteroidi erano associati ad un aumentato rischio di mortalità (risk ratio [RR], 1,75 [IC 95%, 1,3-2,4]; P <.001) e un rischio 2 volte maggiore di infezioni secondarie (RR, 1,98 [IC 95%, 1,0-3,8]; P = 0,04 ). Sebbene l’efficacia dei corticosteroidi nell’ARDS e nello shock settico rimanga più generalmente discussa, Russell e colleghi hanno sostenuto che quelli che hanno maggiori probabilità di beneficiare dei corticosteroidi sono quelli con batteri piuttosto delle infezioni virali. Un recente studio retrospettivo su 201 pazienti con COVID-19 in Cina ha scoperto che, per coloro che hanno sviluppato ARDS, il trattamento con metilprednisolone era associato a un ridotto rischio di morte (23/50 [46%] con steroidi contro 21/34 [62% ] senza; HR, 0,38 [IC al 95%, 0,20-0,72]). Tuttavia, gli autori hanno notato che in questo studio osservazionale possono esistere pregiudizi e confusione residua tra coloro che hanno o non hanno ricevuto steroidi. Pertanto, i potenziali danni e la mancanza di comprovati benefici per i corticosteroidi mettono in guardia contro il loro uso di routine nei pazienti con COVID-19 al di fuori di un RCT a meno che non esista un’indicazione convincente concomitante, come esacerbazione cronica della malattia polmonare ostruttiva o shock refrattario.
ANTICITOCHINA O AGENTI IMMUNOMODULATORI
 Gli anticorpi monoclonali diretti contro le citochine infiammatorie chiave o altri aspetti della risposta immunitaria innata rappresentano un’altra potenziale classe di terapie aggiuntive per COVID-19. La logica del loro uso è che la fisiopatologia sottostante al danno d’organo significativo nei polmoni e in altri organi è causata da una risposta immunitaria amplificata e dal rilascio di citochine, o “tempesta citochinica“. L’Inteleuchina-6 (IL-6) sembra essere un fattore chiave di questo infiammazione sregolata basata sulle prime serie di casi dalla Cina. Pertanto, gli anticorpi monoclonali contro IL-6 potrebbero teoricamente smorzare questo processo e migliorare i risultati clinici. Il Tocilizumab, un anticorpo monoclonale antagonista del recettore dell’IL-6, è approvato dalla FDA per il trattamento della sindrome da rilascio di citochine dell’artrite reumatoide e nella sindrome da rilascio di citochine a seguito della terapia con cellule T del recettore dell’antigene chimerico. Data questa esperienza, tocilizumab è stato utilizzato in piccole serie di casi gravi di COVID-19 con prime segnalazioni di successo. Un report di 21 pazienti con COVID-19 ha mostrato che la somministrazione di tocilizumab, 400 mg, era associata ad un miglioramento clinico nel 91% dei pazienti, misurata da una migliore funzione respiratoria, una rapida defervescenza e una dimissione con successo, con la maggior parte dei pazienti che ricevevano solo 1 dose. La mancanza di un gruppo di confronto limita l’interpretazione dell’effetto specifico del farmaco e richiede cautela fino a quando non saranno disponibili dati più rigorosi. Diversi RCT di tocilizumab, da soli o in combinazione, in pazienti con COVID-19 con polmonite grave sono in corso in Cina (NCT04310228, ChiCTR200002976), ed esso è incluso nelle attuali linee guida di trattamento nazionali cinesi.
Gli anticorpi monoclonali diretti contro le citochine infiammatorie chiave o altri aspetti della risposta immunitaria innata rappresentano un’altra potenziale classe di terapie aggiuntive per COVID-19. La logica del loro uso è che la fisiopatologia sottostante al danno d’organo significativo nei polmoni e in altri organi è causata da una risposta immunitaria amplificata e dal rilascio di citochine, o “tempesta citochinica“. L’Inteleuchina-6 (IL-6) sembra essere un fattore chiave di questo infiammazione sregolata basata sulle prime serie di casi dalla Cina. Pertanto, gli anticorpi monoclonali contro IL-6 potrebbero teoricamente smorzare questo processo e migliorare i risultati clinici. Il Tocilizumab, un anticorpo monoclonale antagonista del recettore dell’IL-6, è approvato dalla FDA per il trattamento della sindrome da rilascio di citochine dell’artrite reumatoide e nella sindrome da rilascio di citochine a seguito della terapia con cellule T del recettore dell’antigene chimerico. Data questa esperienza, tocilizumab è stato utilizzato in piccole serie di casi gravi di COVID-19 con prime segnalazioni di successo. Un report di 21 pazienti con COVID-19 ha mostrato che la somministrazione di tocilizumab, 400 mg, era associata ad un miglioramento clinico nel 91% dei pazienti, misurata da una migliore funzione respiratoria, una rapida defervescenza e una dimissione con successo, con la maggior parte dei pazienti che ricevevano solo 1 dose. La mancanza di un gruppo di confronto limita l’interpretazione dell’effetto specifico del farmaco e richiede cautela fino a quando non saranno disponibili dati più rigorosi. Diversi RCT di tocilizumab, da soli o in combinazione, in pazienti con COVID-19 con polmonite grave sono in corso in Cina (NCT04310228, ChiCTR200002976), ed esso è incluso nelle attuali linee guida di trattamento nazionali cinesi.
 Sarilumab, un altro antagonista del recettore dell’IL-6 approvato per l’artrite reumatoide, è in fase di studio in uno studio multicentrico, in doppio cieco, di fase 2 e 3 per pazienti ospedalizzati con COVID-19 grave (NCT04315298).
Sarilumab, un altro antagonista del recettore dell’IL-6 approvato per l’artrite reumatoide, è in fase di studio in uno studio multicentrico, in doppio cieco, di fase 2 e 3 per pazienti ospedalizzati con COVID-19 grave (NCT04315298).
Altri anticorpi monoclonali o agenti immunomodulatori negli studi clinici in Cina o disponibili per un accesso esteso negli Stati Uniti includono bevacizumab (farmaco anti-fattore di crescita endoteliale vascolare; NCT04275414), fingolimod (immunomodulatore approvato per sclerosi multipla; NCT04280588) ed eculizumab (anticorpo inibitore del complemento terminale ; NCT04288713).
TERAPIA CON IMMUNOGLOBULINE
Un’altra potenziale terapia aggiuntiva per COVID-19 è l’uso di “plasma di convalescenza” o “immunoglobuline iperimmuni“. La logica di questo trattamento è che gli anticorpi provenienti da pazienti guariti possono aiutare sia con il virus libero che con la clearance immunitaria delle cellule infette. Rapporti aneddotici o protocolli per plasma convalescente sono stati riportati come terapia di salvataggio in SARS e MERS.
Uno studio osservazionale prospettico del 2009 su 93 pazienti in condizioni critiche con l’influenza A da H1N1, 20 dei quali hanno ricevuto plasma convalescente, ha dimostrato che la ricezione di plasma di convalescenza rispetto a non recettori è stato associato a una riduzione della mortalità (20% vs 54,8%; P = 0,01).
Nell’ambito di una revisione sistematica del 2015, Mair-Jenkins e colleghi hanno condotto una meta-analisi post hoc di 8 studi osservazionali con 714 pazienti con SARS o influenza grave. La somministrazione di plasma convalescente e immunoglobulina iperimmune è stata associata a riduzione della mortalità (odds ratio, 0,25 [IC 95%, 0,14-0,45]; I2 = 0%) con relativi pochi danni, sebbene la qualità dello studio fosse generalmente bassa ed a rischio di bias. In teoria, i benefici di questa terapia si accumulerebbero principalmente entro i primi 7-10 giorni dall’infezione, quando la viremia è al suo apice e la risposta immunitaria primaria non si è ancora verificata.
Sebbene le attuali preparazioni commerciali di immunoglobuline probabilmente mancano di anticorpi protettivi per SARS-CoV-2, questa modalità garantisce ulteriori studi di sicurezza ed efficacia poiché il pool di pazienti che si sono ripresi da COVID-19 aumenta a livello globale. In effetti, la prima serie di casi incontrollati di 5 pazienti critici con COVID-19 trattati con plasma convalescente in Cina è stata recentemente pubblicata.
Inoltre, una serie di casi di 3 pazienti con COVID-19 a Wuhan, in Cina, trattati con immunoglobuline per via endovenosa alla dose di 0,3 a 0,5 g / kg / die per 5 giorni sono state recentemente pubblicate. Il 24 marzo 2020, la FDA ha pubblicato le linee guida per la richiesta di una nuova domanda sperimentale del farmaco e lo screening dei donatori per il plasma di convalescenza COVID-19. Ci sono anche i primi report di ‘pre-stampa‘ che descrivono lo sviluppo preclinico di un anticorpo monoclonale umano contro un epitopo comune per bloccare l’infezione da SARS-COV-2 (e SARS-CoV).
La strategia più efficace a lungo termine per la prevenzione di futuri focolai di questo virus sarebbe lo sviluppo di un vaccino che fornisce l’immunità protettiva. Tuttavia, un minimo di 12-18 mesi sarebbero richiesti prima della diffusione del vaccino. Una revisione completa della ricerca sui vaccini per SARS-CoV-2 va oltre lo scopo di questa recensione.
conclusioni
La pandemia di COVID-19 rappresenta la più grande crisi globale di salute pubblica di questa generazione e, potenzialmente, dall’epidemia di influenza pandemica del 1918. La velocità e il volume degli studi clinici avviati per indagare su potenziali terapie per COVID-19 evidenziano sia la necessità che la capacità di produrre prove di alta qualità anche nel mezzo di una pandemia. Nessuna terapia è stata dimostrata efficace fino ad oggi.
TRATTO DA:
- “Pharmacologic Treatments for Coronavirus Disease 2019 (COVID-19)“, A Review. di
James M. Sanders, PhD, PharmD (“Department of Pharmacy, University of Texas Southwestern Medical Center“, Dallas); Marguerite L. Monogue, PharmD; Tomasz Z. Jodlowski, PharmD; et al; pubblicato su JAMA il 13 aprile 2020.