Le tappe storiche che hanno portato alla scoperta del gruppo ematico AB0
- articolo del prof. Sergio Barocci
Il significato di gruppo sanguigno
 La natura ha dotato il sistema immunitario degli esseri umani di un software molto sofisticato e preciso che si fonda sul riconoscimento di particolari sostanze chimiche definite “antigeni”, che possono essere tollerate oppure combattute in caso di estraneità.
La natura ha dotato il sistema immunitario degli esseri umani di un software molto sofisticato e preciso che si fonda sul riconoscimento di particolari sostanze chimiche definite “antigeni”, che possono essere tollerate oppure combattute in caso di estraneità.
Se prendiamo in considerazione alcune cellule del nostro apparato circolatorio come ad esempio i globuli rossi, essi espongono sulla loro membrana molecole di riconoscimento (vere e proprie impronte digitali biologiche) che rappresentano diversi tipi di antigeni esclusivi, correlati ai gruppi sanguigni e considerati tra i più potenti del pool antigenico umano, la cui sensibilità fornisce un sistema di allarme molto efficiente e vigile.
VARIETA’ ANTIGENICHE DI MEMBRANA
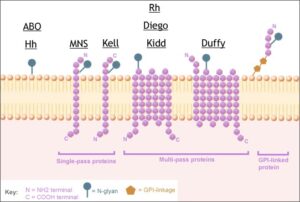
E’ la combinazione di queste varietà antigeniche di membrana che distingue le cellule di un individuo da quelle di un altro e in più la loro presenza definisce l’appartenenza a uno dei gruppi sanguigni.
Quando si parla di gruppi sanguigni o ematici, in genere, si pensa al sistema AB0 soprattutto per il problema delle incompatibilità nelle trasfusioni di sangue e nei trapianti d’organo o al sistema Rh per quanto riguarda invece le incompatibilità materno-fetali. In realtà, si deve tener presente che, sulla membrana dei globuli rossi, sono presenti anche altri determinanti antigenici, raggruppati in circa una trentina di sistemi che annoverano, oltre all’AB0 ed Rh, anche i sistemi Lewis, MN, Duffy, Kidd, Lutheran, P, Kell, Xg e Bombay (legato al sistema AB0), tra i più comuni, e che costituiscono il gruppo sanguigno di ciascun individuo.
GRUPPO SANGUIGNO
 Pertanto, per gruppo sanguigno o gruppo ematico si intende un sistema di classificazione del sangue e degli individui basato sulla presenza o assenza ereditaria di determinate strutture antigeniche localizzate sulla membrana dei globuli rossi la cui sintesi avviene sotto il controllo di geni appartenenti ad un’unica regione cromosomica.
Pertanto, per gruppo sanguigno o gruppo ematico si intende un sistema di classificazione del sangue e degli individui basato sulla presenza o assenza ereditaria di determinate strutture antigeniche localizzate sulla membrana dei globuli rossi la cui sintesi avviene sotto il controllo di geni appartenenti ad un’unica regione cromosomica.
Queste strutture possono essere immaginate come delle antenne sporgenti, costituite da due parti: uno stelo che serve da supporto e una estremità che funge invece da ricevente e trasmittente.
UNO STELO ED UN’ESTREMITà

Gli antigeni dei gruppi ematici vengono trasmessi secondo le leggi mendeliane come caratteri autosomici codominanti e sono determinati da geni allelici che segregano indipendentemente rispetto a quelli di altri sistemi, oppure congiuntamente come nel caso di antigeni strettamente collegati (es. sistema Rh) in quanto appartenenti allo stesso sistema.
Solo nel caso dell’antigene Xg-a la trasmissione è legata al sesso (cromosoma X).
La conoscenza di tutti questi aspetti rappresenta la base teorica della Medicina Trasfusionale di oggi.
OMOZIGOTI ED ETEROZIGOTI

Si definiscono invece alleli quei geni che occupano sui cromosomi omologhi lo stesso locus e che influenzano lo stesso carattere. Essi possono essere uguali o “omoalleli” e l’individuo viene definito omozigote per quel carattere oppure diversi o “eteroalleli” e l’individuo in questo caso viene chiamato eterozigote per quel carattere. Nel caso di alleli uguali, il carattere manifesto o fenotipo sarà uguale al genotipo o corredo genetico mentre nel caso di alleli diversi il fenotipo è dovuto all’azione di uno solo dei due alleli in quanto dominante rispetto all’altro detto recessivo (situazione di dominanza e rispettivamente di recessività) o presentare entrambi i caratteri (codominanza) o ancora presentare un carattere intermedio fra quelli determinati dai due geni (intermediante). Il sistema AB0 è un classico esempio di codominanza in quanto gli eterozigoti manifestano entrambi i fenotipi (caratteri) degli omozigoti.
Quasi tutti i sistemi sanguigni sono codificati da più geni o alleli multipli e anche se un locus può avere molti alleli, un individuo diploide ne possiede solo due. Di questi alleli, alcuni sono molto frequenti, mentre altri sono rari e determinati da mutazioni o da situazioni genetiche molto particolari.
Nascita della pratica trasfusionale: da Erofilo a Landsteiner

L’uso del sangue come medicamento, risale all’antichità come elemento fondamentale per la vita, “un succo del tutto particolare”. Si può trovare il suo utilizzo già nelle iscrizioni degli antichi templi egizi, negli scritti anatomici di Erofilo della scuola alessandrina e nel sacro libro dei Sacerdoti di Apollo.
Erofilo studiò anatomia praticando dissezioni sul corpo umano, descrivendo con precisione molte formazioni anatomiche, quali i nervi distinguendoli dai tendini e individuando nel cervello il centro del sistema nervoso e la sede dell’intelligenza. Inoltre, fu il primo anche a distinguere le arterie dalle vene e i nervi sensori dai nervi motori. Oggetto dei suoi studi anatomici furono anche l’occhio, il fegato, il pancreas, l’apparato digerente, l’apparato respiratorio, gli organi salivari e gli organi genitali.
ANTICA ROMA

Già nell’antica Roma in alcune opere mediche e letterarie di quel tempo, come ad esempio nelle “Metamorfosi” di Ovidio (Publio Ovidio Nasone, noto semplicemente come Ovidio, 43 a.C. – 17 o 18 d.C), ed ancora di più nel Medioevo, era descritto l’uso frequente di effettuare dei salassi.
Si trattava di fuoriuscite di sangue controllate che venivano ritenute rigenerative per donare forza, bellezza o giovinezza; ipotizzare che ciò avvenisse in senso trasfusionale rappresenta tuttavia una forzatura poiché ancora nulla si sapeva dell’esistenza della circolazione sanguigna.
In realtà, questi salassi risultavano molto spesso deleteri per un organismo già debilitato mentre sembrava più probabile che la somministrazione del sangue avvenisse, invece, piuttosto per via orale, come pratica magica, comune a molti popoli e a molte epoche, ancor prima che medica.
sangue da bere
|
|
|
Anche Celso, in senso terapeutico, pur nutrendo qualche dubbio nel suo trattato “De Medicina” – un libro dove sono descritte diverse fonti di informazioni sulle pratiche mediche dell’epoca – racconta come anche i Romani si affrettassero a bere il sangue freddo che sgorgava dalle ferite di gladiatori appena sgozzati per curare l’epilessia.
dopo il medioevo
Fino al Medioevo non si legge più nulla del sangue come medicamento. Solo intorno alla fine del XV sec. viene riferita una cura di ringiovanimento da parte di un medico ebreo intrapresa sul Pontefice Innocenzo VIII attraverso l’ingestione come farmaco del sangue a gocce prelevato ad alcuni giovani.
Ma fu agli inizi del XVII secolo che si incominciò a descrivere con esattezza la trasfusione di sangue, dapprima nel 1604 da parte del medico tedesco Magnus Pegel (15maggio 1547 – 1619) e poi, nel 1615, da parte di Andreas Libavius (Halle, 1555 – Coburgo, 25luglio 1616).
CIRCOLAZIONE SANGUIGNA e trasfusione

Nel 1593, l’italiano Andrea Cisalpino (1524 ca – 23febbraio 1603), di Arezzo, fornisce le prime scoperte sulla circolazione del sangue anche se poi è l’inglese William Harvey, formatosi all’Università di Padova, ad approfondirle nel 1628.
Solo dopo la scoperta dei vasi sanguigni nel 1616, ad opera di William Harvey, descritta nel suo “De Motu Cordis” che la scienza medica della trasfusione sanguigna incominciò a dirigersi nella direzione opposta al salasso, arrivando nel 1667 alla prima notizia certa di una trasfusione ad opera di un medico del re di Francia Luigi XIV, un certo Jean Baptiste Denys (1643 – 3ottobre 1704), che trasfuse il sangue di un agnello in un giovane, malato di tifo; fu poi arrestato per omicidio in seguito alla morte del paziente.
l’abbandono della pratica

La pratica della trasfusione di sangue si diffuse anche in altri paesi europei ma con risultati negativi (veniva utilizzato principalmente del sangue animale) per poi venire immediatamente abbandonata come fece, nel 1679, il Governo Pontifico a Roma che ne proibì la pratica.
Perché la trasfusione sanguigna potesse essere coronata da un certo successo e venire nuovamente affrontata dalla scienza medica, si dovette attendere il 1818, quando un ostetrico inglese di nome James Blundell, la utilizzò per trasfondere il sangue del marito in una sua paziente colpita da un’ emorragia post partum dopo precedenti esperimenti fatti tra animale-animale e animale-uomo.
Negli anni successivi Blundell praticò altre trasfusioni, sempre con sangue umano, ottenendo in circa la metà dei casi esiti favorevoli mentre nell’altra metà degli insuccessi mortali, ignorando i principi della trasfusione di sangue.
scoperta del fenomeno dell’agglutinazione

Da questo momento, si incominciò a capire che il sangue umano poteva essere un popolare mezzo terapeutico che non comportava grossi rischi nonostante rimanessero ancora alte le possibilità di reazioni mortali.
La vera rivoluzione nella conoscenza delle reazioni trasfusionali e del fenomeno dell’agglutinazione dei globuli rossi avvenne rispettivamente nel 1875 ad opera del fisiologo tedesco Leonard Landois (Münster, 1dicembre 1837 – Greifswald, 17novembre 1902) e poi nel 1901 ad opera di Karl Landsteiner a cui viene associata la scoperta del sistema AB0.
Landois dimostrò il fenomeno dell’emolisi, cioè della rottura degli eritrociti, quando questi venivano prelevati da una specie di animale e successivamente mescolati con il siero prelevato da un altro animale di specie diversa. Egli interpretò questo risultato sulla base del comportamento di agglutinazione dei batteri con un appropriato siero immune, come una reazione antigene-anticorpo.
la scoperta dei gruppi sanguigni A, B E ZERO

Successivamente Karl Landsteiner, influenzato da un articolo scritto nel 1900 da Paul Ehrlich sui gruppi sanguigni nelle capre, e apparso sulla Rivista “Berliner klinische Wechenschrift” (Il Settimanale Clinico di Berlino), fornì nel 1901, in una pubblicazione, la risposta di come i globuli rossi agglutinavano (a causa della presenza di agglutinine nel sangue) e ostruivano i vasi più sottili, scoprendo nella specie umana tre gruppi sanguigni che vennero chiamati A,B e 0 (zero), la cui genetica venne sancita nel 1909 e completamente spiegata nel 1924.
In realtà, Landsteiner indicò il gruppo 0 con C e solo nel 1911 venne introdotto il simbolo 0 secondo le proposte dei biologi Emil von Dungern (Würzburg, 26settembre 1867 – Ludwigshafen am Bodensee, 4settembre 1961) e Ludwik Hirszfeld (Varsavia, 5agosto 1884 – Breslavia, 7marzo 1954).
comprensione delle reazioni trasfusionali

La scoperta del gruppo sanguigno AB0 pose le basi immunologiche per la comprensione delle reazioni trasfusionali. Trent’anni dopo dalla sua scoperta, Landsteiner ricevette il premio Nobel per la Fisiologia e la Medicina.
Nel 1902, Alfredo De Castello e Adriano Sturli (1873-1966), colleghi di Landsteiner a Vienna, scoprirono il quarto gruppo, molto raro, che venne chiamato AB. Con quest’altra scoperta si intuì quali erano state le cause degli insuccessi nel passato e, solo da questo momento, le trasfusioni di sangue divennero più sicure.
Nel 1907, il medico statunitense Reuben Ottenberg (1882-1959), trasfondendo con successo del sangue tra due individui presso il Mount Sinai Hospital di New York, divenne la prima persona a registrare i test pre-trasfusionali per la compatibilità sanguigna in ambiente clinico.
QUATTRO GRUPPI SANGUIGNI

I gruppi vennero quindi denominati in base alla presenza (o all’assenza) sui globuli rossi di due sostanze (la sostanza A e quella B). Tuttavia, solo nel 1929 il Comitato Igiene della Lega delle Nazioni fissò definitivamente la nomenclatura del sistema confermando i simboli: 0, A, B, AB.
Nel 1939, Karl Landsteiner, insieme all’immunologo statunitense Alexander Solomon Wiener (New York, 16marzo 1907 – New York, 6novembre 1976), scopre il cosiddetto fattore Rhesus (Rh), che è il responsabile per l’eritroblastosi fetale, cioè la malattia che insorge nei feti che hanno un gruppo sanguigno incompatibile con quello della madre e, per questo, vengono attaccati dal suo sistema immunitario.
Il sistema AB0

Landsteiner, nel celebre esperimento del 1900 con il quale scopri il sistema AB0, si servì di un campione del suo sangue e di quelli di altri cinque suoi colleghi.
Dopo aver separato il siero dai globuli rossi, cimentò ciascuna sospensione eritrocitaria con ciascun siero nelle varie combinazioni. In alcuni casi i globuli rossi apparivano agglutinati ed egli concluse che tale risultato fosse dovuto alla presenza sulla superficie cellulare eritrocitaria di due antigeni o agglutinogeni e che fosse possibile suddividere gli individui esaminati e, verosimilmente tutti gli esseri umani, in tre gruppi:
- Gruppo A, per la presenza dell’antigene A sui globuli rossi,
- Gruppo B, per la presenza dell’antigene B,
- Gruppo 0, per l’assenza sia dell’antigene A sia di quello B.
L’agglutinazione era dovuta alla presenza nel siero di particolari anticorpi agglutinanti o “agglutinine” che si legavano agli antigeni eritrocitari.
REATTIVITà CROCIATA

Poiché nessuno degli individui che aveva partecipato all’esperimento era stato trasfuso con globuli rossi, Landsteiner dedusse che ogni soggetto doveva possedere “anticorpi naturali” nel suo siero, specifici per gli antigeni che non erano presenti sulle proprie cellule.
Quindi, gli individui di gruppo A avevano anticorpi naturali anti-B nel loro siero, quelli appartenenti al gruppo B, anticorpi naturali anti-A mentre quelli appartenenti al gruppo 0 avevano nel loro siero sia l’anticorpo anti-A sia l’anticorpo anti-B.
Sia gli anti-A che gli anti-B erano responsabili della “reattività crociata“, meccanismo alla base del fenomeno dell’incompatibilità trasfusionale.
Due anni più tardi, due collaboratori di K. Landsteiner, il viennese Alfredo De Castello e il triestino Adriano Sturli, scoprirono in un individuo la presenza di entrambi gli antigeni sui propri globuli rossi. Questo soggetto venne classificato di gruppo AB e, come era prevedibile, non si rinvenne nel suo siero nè l’anticorpo anti-A e né l’anticorpo anti-B.
ANTIGENI ED ANTICORPI
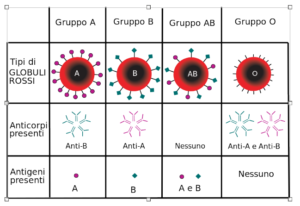
Tali studi portarono quindi a concludere che il sistema AB0 (Fig. 1) nell’uomo fosse basato sulla presenza dell’antigene a livello della superficie cellulare del globulo rosso e che in ogni singolo individuo potesse essere riconosciuto uno di questi quattro gruppi: 0 anti-A anti-B, A anti-B, B anti-A, AB nessun anticorpo. Inoltre, fu osservato che, alla nascita, gli antigeni A, B ed il loro precursore glicosfingolipidico o sostanza H non erano ancora completamente espressi anche se la loro presenza poteva essere dimostrata su eritrociti di embrioni di 5-6 settimane. Studi successivi evidenziarono come, con gli antisieri specifici, gli eritrociti di neonati reagissero più debolmente di quelli dell’adulto e che gli antigeni del sistema AB0 raggiungessero il completo sviluppo solo verso i 2-4 anni, mantenendosi poi costanti per tutta la vita.
Antigene A1 ed Antigene A2

La genetica di questo sistema si ampliò in seguito alle scoperte di E. von Durgen e di L. Hirszefeld, i quali, nel 1911, studiando attentamente i sieri anti-A (da soggetti di gruppo B), dimostrarono che il gruppo A poteva essere ulteriormente suddiviso in due sottogruppi: A1 (il più numeroso, circa l’80%) e A2 (circa il restante 20%).
La differenza tra l’antigene A1 e l’antigene A2 probabilmente è legata al numero di siti antigenici e alla loro diversa distribuzione sulla superficie dei globuli rossi.
Sierologicamente, tale classificazione, viene definita mediante l’impiego di due reagenti. I comuni antisieri anti-A non consentono di differenziare i due sottogruppi, mentre ciò è possibile con reagenti specifici, in quanto agglutinano le emazie A1 ma non le A2.
VARIABILITà DI FREQUENZA

Le emazie di circa l’80% dei soggetti che possiedono l’antigene A vengono agglutinate dai sieri anti A1. Questi individui vengono classificati A1 o A1B. Il rimanente 20%, le cui emazie sono agglutinate dai reagenti anti-A ma non dagli anti-A1 vengono classificati invece come A2 o A2B.
Nella pratica trasfusionale non è necessario determinare a quale sottogruppo di A appartenga il donatore o il ricevente, tranne il caso in cui i soggetti A2 o A2B posseggano nel loro siero anticorpi anti-A1. Questi anticorpi anti-A1 si riscontrano in circa l’1- 8% dei soggetti A2 e in circa il 22-35% dei soggetti A2B. Gli Antigeni del sistema AB0 presentano una certa variabilità di frequenza da una popolazione all’altra in relazione alle differenze etniche fra i popoli.
variabilità geografiche
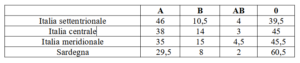
Molti nativi sudamericani, ad esempio, sono prevalentemente di gruppo 0. In Europa e nel Nord America dominano rispettivamente i gruppi A e 0, mentre nell’Asia centrale è più rappresentato il gruppo B.
La Tabella 1 riporta i valori percentuali riferiti alla media dell’intera popolazione italiana nazionale dove esistono anche alcune differenze tra le varie aree geografiche.
ANTIGENI PRESENTI IN ALTRI TESSUTI
Gli antigeni AB0 non sono esclusivi dei globuli rossi, ma si trovano anche sulle cellule di molti tessuti e liberi nei liquidi corporei. Antigeni strutturalmente simili si trovano anche nel mondo vegetale e nei batteri.
La determinazione del gruppo ematico AB0 comporta necessariamente:
• La ricerca degli antigeni o agglutinogeni sui globuli rossi (prova diretta).
• La ricerca degli anticorpi o isoemoagglutinine nel siero (prova indiretta).
• Le emazie 0 sono compatibili con tutti gli altri gruppi perché prive degli antigeni A e B (emazie universali);
• Il plasma 0 è trasfondibile solo a pazienti 0 perché contiene sia anticorpi Anti A che anticorpi anti B;
• Le emazie AB sono compatibili solo con i soggetti AB perché contengono entrambi gli antigeni;
• Il plasma AB è trasfondibile a chiunque perché non contiene anticorpi anti A né anti B (plasma universale);
Le varianti deboli del sistema AB0

Sono state descritte anche delle altre varianti deboli a carico dell’antigene A caratterizzate da un basso numero di siti antigenici A e dal corrispondente aumento di sostanza H e, meno frequentemente anche a carico dell’antigene B. I geni responsabili di tali varianti costituiscono meno dell’1% del totale dei geni A. La più comune variante dell’antigene A è l’A3, la cui caratteristica sierologica è quella di determinare una reazione dei globuli rossi con il comune reagente anti-A definita “a campi misti” (“mixed-field”) poiché le emazie agglutinate si alternano ad altre emazie che non mostrano la medesima reazione.
Le emazie A3 vengono agglutinate dal siero AB. Con il siero anti H i globuli rossi A3 reagiscono più intensamente dei globuli rossi A1. Inoltre, negli individui con la variante A3 possono essere occasionalmente presenti anticorpi anti-A1.
Per quanto riguarda i sottogruppi B deboli, essi sono ancora meno frequenti e i criteri per la loro differenziazione sono analoghi a quelli del gruppo A.
Genetica del sistema AB0
Fenotipi o gruppi |
Genotipi |
| A1 |
A1A1 A1A2 A1 0 |
| A2 |
A2A2 A2 0 |
| B |
B B B 0 |
| A1B | A1B |
| A2B | A2B |
| 0 | 00 |
|
Tabella 2: Genotipi e Fenotipi del sistema AB0 |
Tabella 2: Genotipi e Fenotipi del sistema AB0 |
Gli antigeni AB0 rappresentano dei caratteri ereditari trasmessi secondo le leggi mendeliane controllati da un gene situato sul Cromosoma 9 capace di esprimersi con tre forme alternative o alleli: A,B,0 o IA,IB, I0. In seguito alla suddivisione dell’antigene A in A1 e A2, il numero degli alleli è stato elevato a quattro: A1, A2 ,B, 0. Ciascun genitore trasmette alla prole uno dei quattro possibili alleli che possono dar luogo a fenotipi e genotipi diversi come indicato nella Tabella 2.
BERNSTEIN E L’EREDITA’ DEGLI ANTIGENI AB0
Si deve al matematico tedesco Felix Bernstein la definizione, nel 1924, delle modalità con cui gli antigeni AB0 venivano ereditati attraverso l’applicazione della legge di Hardy-Weinberg. Egli ipotizzò l’esistenza di un singolo locus con tre alleli A,B e 0 con i geni A e B codominanti ed entrambi dominanti su 0 recessivo o “amorfo”. Ciascun genitore trasmette al figlio uno dei tre possibili alleli che possono dar luogo ai fenotipi e ai genotipi elencati in Tabella 2.
Poiché il gene 0 è amorfo, cioè non in grado di esprimere alcun antigene o un suo carattere, viene mascherato negli individui eterozigoti quando sull’altro cromosoma vi sia il gene A1, A2 o B. Anche il gene A1 domina completamente su A2.
Questo è il motivo per cui ad un determinato antigene o fenotipo possono corrispondere più genotipi. Ad esempio al fenotipo A1 possono corrispondere tre genotipi A1-A1, A1-A2, A1-0. In totale vi sono quindi 6 fenotipi a cui corrispondono 10 genotipi.
GENOTIPI E FENOTIPI
Il numero di genotipi possibili per un numero di alleli o complessi genici n è dato dalla seguente formula: n (n +1)/2, dove n = numero di alleli
Esempio: 4 alleli n = 4 (4+1)/2 = 10 genotipi
Per risalire dal fenotipo (antigene, gruppo) di un individuo al genotipo, cioè per conoscere se il soggetto ad es. di gruppo B sia geneticamente BB o B0 occorre effettuare uno studio familiare. Lo studio della trasmissione ereditaria ha infatti reso possibile la loro applicazione in campo medico-legale nell’esclusione di paternità.
TERMINOLOGIA SEMPLIFICATA
La terminologia è stata semplificata e gli individui 00 sono definiti di gruppo 0, quelli AA o A0 definiti di gruppo A e i soggetti BB o B0 definiti di gruppo B. Infine, i soggetti AB sono definiti di gruppo AB .
Ricapitolando: per il sistema AB0 si hanno:
4 fenotipi → A, B, AB e 0
3 alleli → IA, IB e I0
Dove IA e IB sono codominanti (si esprimono contemporaneamente) ed I0 recessivo
Quindi: N = 3 X (3+1) / 2 = 6 genotipi
Pertanto, il sistema AB0 si basa sull’antigene presente a livello della superficie cellulare del globulo rosso.
IA/- → antigene A; IB/- → antigene B; IA/IB → antigeni A e B; I0/I0 → nessun antigene
Il fenotipo Bombay
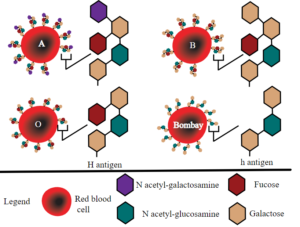
I gruppi A, B e AB sono caratterizzati dalla presenza, sulla superficie dei globuli rossi, di particolari antigeni. Questi antigeni sono generati dal legame tra una molecola detta sostanza H ed uno zucchero, che si forma per mezzo di enzimi detti glicosil transferasi A o B. Quando tali enzimi sono assenti come nel caso del gruppo 0, la sola presenza della sostanza H non basta a generare l’antigene.
La sostanza H viene prodotta da un enzima chiamato fucosil-transferasi che viene codificato dal gene H sul Cromosoma 19. La presenza o meno del fucosio è sotto il controllo di una coppia di alleli, i geni H (capacità di produrre la sostanza H) e h (incapacità), indipendenti dai geni A e B.
LA SOSTANZA H

Solo il gene H, anche se allo stato eterozigote (Hh), è in grado di aggiungere il fucosio mentre il gene h è amorfo. Quindi, la presenza di questo gene h allo stato omozigote (hh) comporta il mancato legame del fucosio e di conseguenza non solo non produce la sostanza H, ma anche le sostanze con funzione antigenica A e B.
Quindi, i globuli rossi di soggetti omozigoti per gene “h” risultano privi degli antigeni A, B, o H. Lo studio di questi geni Hh ha permesso di spiegare il raro fenotipo Bombay o 0h, descritto per la prima volta da Y. M. Bhende nel 1952 in India, a Bombay, dove è risultato più frequente che altrove. Nella popolazione mondiale, è presente nel 0,0004%.
Nei test di determinazione del gruppo AB0 gli eritrociti 0h appaiono di gruppo 0 in quanto nel test indiretto il siero agglutina sia le emazie di gruppo A che di gruppo B. L’agglutinazione delle emazie A e B è dovuta alla presenza nel siero dei soggetti 0h di anticorpi anti H la cui formazione è determinata dall’assenza di sostanza H negli eritrociti di gruppo 0h. Tali anticorpi agglutinano sia le emazie A che B.
un siero agglutina anche le emazie di gruppo 0

Il sospetto che il soggetto non possa appartenere al gruppo 0 viene dall’osservazione che il suo siero agglutina anche le emazie di gruppo 0. La conferma, invece, che il soggetto in esame appartiene al gruppo 0h si ha cimentando i suoi eritrociti con un reagente capace di reagire specificatamente con la sostanza H. Questo reagente è rappresentato da un estratto salino di Ulex Europaeus. Le emazie in esame, mancando della sostanza H, non reagiranno con questo specifico reagente. La controprova si ha nel caso in cui si disponga di emazie di fenotipo “Bombay” dimostrando che esse non vengono agglutinate dal siero del soggetto. Quindi, la peculiarità del fenotipo Bombay sta nel non possedere la sostanza H sui globuli rossi, ma nel possedere invece nel siero potenti anticorpi naturali anti-H.
Dal punto di vista trasfusionale, gli individui portatori del fenotipo Bombay (non avendo la sostanza H e producendo anticorpi anti-H) possono ricevere solo donazioni da altri individui di gruppo 0h. Questo rappresenta un grande problema in caso di emergenza trasfusionale, poiché tale gruppo risulta estremamente raro. Fortunatamente, essendo il gene h recessivo, il gruppo 0h o Bombay viene riscontrato solitamente in famiglie o in piccole comunità nei quali risulta possibile trovare altri individui dello stesso gruppo.
Le ricerche negli anni ’50 e ’60 del secolo scorso

In seguito alla scoperta del fenotipo “Bombay” e agli studi di R. Ceppellini e B. Levine degli anni ’50 e a quelli successivi di W.H. Watkins, W.T. Morgan e di Elvin Abraham Kabat intorno agli anni ’60 si ipotizzò che su una sostanza di base, o sostanza precursore, dovesse agire un altro sistema genetico biallelico Hh, indipendente dall’AB0.
Il fenotipo Bombay doveva essere il risultato del raro genotipo omozigote h/h che impediva la trasformazione sui globuli rossi della sostanza di base in antigene H, essendo il gene h “amorfo”, cioè incapace di produrre alcun antigene. Secondo questa teoria una coppia di alleli Hh controllava la produzione di un antigene H trasformando la sostanza “precursore” di natura glicolipidica. Il gene H è dominante su h che risulta invece recessivo e non in grado di convertire la sostanza precursore in antigene H (questo avviene negli individui omozigoti hh).
ANTIGENE H
Una volta che l’antigene H si è formato, agirebbero i geni del sistema AB0 e, mentre i primi due, A e B, agirebbero sull’antigene H producendo quantitativi o tipi diversi di antigeni A o B a seconda che l’individuo sia Al, A2 o sia provvisto di altri “sottogruppi” di A e B, il gene 0, essendo “amorfo”, non effettuerà alcuna conversione dell’antigene H, cosicché il globulo rosso conterrà solo i determinanti antigenici H.
I rarissimi individui con fenotipo “Bombay” che risultano essere omozigoti hh, come già detto in precedenza, non sono in grado di trasformare la sostanza “precursore” in antigene H e pertanto le loro emazie non presentano nessun antigene nè del sistema Hh, nè tantomeno del sistema AB0 ma, avendo ereditato i geni AB0, essi possono trasmetterli alla loro prole. Il loro fenotipo viene descritto come 0h.
Successivamente, altre ricerche di tipizzazione condotte su altre famiglie con questo particolare fenotipo, hanno permesso di individuare soggetti che non mostravano un’assenza completa degli antigeni A e B poiché i loro globuli rossi, cimentati con sieri anti-A o anti-B, avevano una debole agglutinazione. Questi fenotipi furono definiti para-Bombay ipotizzando che, pur in presenza del gene h in forma omozigote, si potesse formare una piccola quantità di antigene H, su cui si potevano comunque legare gli antigeni A o B.
L’antigene H è riconoscibile dal punto di vista sierologico da due tipi di anticorpi: a) un’agglutinina che compare nel siero di soggetti, normalmente Al o A1B, sulle cui emazie l’antigene H è presente in scarsa quantità, b) un anticorpo prodotto da rarissimi soggetti di fenotipo Bombay.
Il carattere secretore
Gli antigeni A e B e la sostanza H si trovano sulla membrana cellulare di quasi tutte le cellule dell’organismo ad eccezione delle cellule nervose. Ulteriori ricerche hanno dimostrato che non tutti gli individui possiedono queste sostanze gruppo specifiche presenti nei secreti organici (saliva, succo gastrico, sudore e lacrime) ma solamente il 78%, i cosiddetti “secretori”.
Il carattere di secretore è ereditario ed è trasmesso da una coppia di alleli Se/se in un locus indipendente da quello AB0. I secretori possono essere omozigoti Se/Se oppure eterozigoti Se/se mentre i non secretori sono omozigoti recessivi se/se. Gli individui secretori secernono la stessa sostanza che è presente sui globuli rossi; quindi, i soggetti di gruppo A secernono la sostanza A e H , i soggetti di gruppo B la sostanza B e H mentre i soggetti di gruppo 0 solo la sostanza H.
Anticorpi anti-A e anti-B
Gli anticorpi anti-A e anti-B agglutinanti vengono definiti “naturali” poiché la loro produzione avviene spontaneamente e non come conseguenza di uno stimolo rappresentato da eritrociti estranei. La stimolazione con antigeni A e B determina la produzione di anticorpi di specificità uguale a quella degli anticorpi naturali, ma con differente comportamento biologico. Questi anticorpi vengono definiti “immuni”. L’immunizzazione può essere determinata da una gravidanza con feto AB0 incompatibile. In genere gli anticorpi “naturali” presenti nei soggetti di gruppo A o B appartengono alla classe IgM mentre quelli prodotti in seguito alla stimolazione sono più frequentemente di classe IgG.
Biochimica del sistema AB0
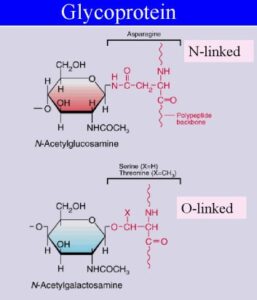
Le indagini sierologiche volte all’identificazione e caratterizzazione del sistema AB0 hanno permesso di chiarire che gli antigeni del sistema AB0 sono presenti, non solo nel sangue, ma anche su altri tessuti e nei secreti di circa il 75% degli individui, definiti secretori, dipendendo da un altro sistema genetico Se/se.
È stato visto che nella loro biosintesi possono intervenire anche altri sistemi genetici come il sistema H/h, con modalità però più complesse. Il classico concetto “un gene, un antigene”, non sempre può essere applicato a questi sistemi antigenici per il verificarsi del fenomeno della epistasi (forma di interazione fra geni) cioè di una situazione che avviene quando una coppia di alleli copre l’espressione fenotipica di un’altra coppia di alleli; in altre parole, quando l’espressione fenotipica di un genotipo ad un locus dipende dal genotipo di altri loci.
I geni che codificano gli antigeni AB0 sono localizzati nel braccio lungo del Cromosoma 9 mentre i geni del sistema H/h che codificano per l’antigene H, substrato accettore dei residui glucidici immunodominanti A e B, sono localizzai sul Cromosoma 19.
metodiche sempre più specifiche nel corso dei decenni
Intorno agli anni’60 del novecento, ulteriori conoscenze sul sistema AB0 sono state rese possibili grazie a studi biochimici mediante l’impiego di metodiche sempre più specifiche che hanno confermato gran parte delle precedenti indagini sierologiche. In particolare, le specificità ABH sarebbero legate ad una componente saccaridica ed al tipo di legame che quattro zuccheri immunodominanti (D-galattosio, L-fucosio, N-acetil galattosamina o GalNAc, N-acetil glucosamina o Glc NAc) assumerebbero nella parte terminale di una catena oligosaccaridica definita sostanza di base sulla quale avverrebbe poi la biosintesi degli antigeni AB0 (secondo le indicazioni degli studi condotti da W.T. Morgan e W.H. Watkins) ma anche di altri antigeni dei sistemi Lewis, P, I e i.
Quindi, dal punto di vista biochimico, la formazione dei due antigeni A e B dipende dall’azione di un enzima (glicosiltrasferasi) che esiste in due forme: la A codificata dall’allele IA e la B codificata dall’allele IB che differiscono tra loro per 4 aminoacidi nelle posizioni 176, 235, 266, 268.
La diversa composizione aminoacidica conferisce alle due forme di glicosil-transferasi delle proprietà leggermente diverse (specificità di substrato differenziale): la forma A addiziona N-acetil-galattosammina (gli omozigoti AA e gli eterozigoti A0 produrranno l’antigene A), mentre la forma B addiziona un D-galattosio (gli omozigoti BB e gli eterozigoti B0 produrranno l’antigene B.
LA SOSTANZA H
Entrambe si associano ad un glicosfingolipide o sostanza H (precursore comune) formato da galattosio-N acetil glucosammina-galattosio a cui un’altra glicosil trasferasi (fucosil-transferasi), la H, (sistema H/h cromosoma 19), non allelica a quelle del sistema AB0 (Cromosoma 9), addiziona un L-fucosio. Gli eterozigoti AB, invece, formano sia gli antigeni A che quelli B.
Il terzo allele I0 del sistema AB0, al contrario degli alleli IA e IB codifica una transferasi completamente inattiva (priva di attività enzimatica) che non può aggiungere alcuno zucchero per cui i globuli rossi di gruppo 0 esprimeranno sulla loro superficie solo la sostanza H non modificata (antigene 0), a sua volta determinata da una molecola di fucosio.
SISTEMA AB0
Quindi, i gruppi A e B si possono formare solo in presenza dell’azione svolta dall’enzima H.
In definitiva:
1. L’antigene A è la sostanza H + l’alfa-N- acetil galattosamina che rappresenta il determinante antigenico dei globuli rossi di gruppo A.
2. L’antigene B è la sostanza H + l’alfa D-galattosio che diventa così il determinante antigenico del gruppo B.
3. L’antigene 0 è la sostanza H non modificata espressa sulla superficie dei globuli rossi.
4. L’antigene AB è la sostanza H + l’alfa N-acetil galattosamina e l’alfa D-galattosio.
Biologia molecolare del sistema AB0
A partire dagli anni ‘80 del novecento, con l’utilizzo di tecniche di biologia molecolare, è stato possibile un nuovo approccio nello studio del sistema AB0 che ha permesso di individuare il meccanismo genetico che controlla, a livello molecolare, l’espressione dei suoi antigeni. In quel periodo, iniziarono infatti ad essere clonati i geni codificanti gli enzimi che determinano gli antigeni AB0.
La disponibilità di cDNA codificante per alcune glicosiltransferasi ha così reso possibile una ottimale caratterizzazione delle proprietà catalitiche di tali enzimi, così da definire, da una parte il loro ruolo biosintetico specifico e dall’altra, di poter indagare il ruolo funzionale della specifica catena glucidica sintetizzata.
analisi delle sequenze nucleotidiche
Attraverso l’analisi delle sequenze nucleotidiche dei cloni di cDNA delle regioni che codificano gli alleli del sistema AB0 si sono potute identificare delezioni (assenza di un tratto di un cromosoma, con conseguente perdita di materiale nucleotidico) o mutazioni responsabili delle differenti specificità e attività delle transferasi localizzate sugli esoni (triplette di basi specifiche per ogni aminoacido) e rispettivamente sia sul 6° esone (tripletta (pb 240-374) che sul 7° esone (pb 375-1062).
Nel caso della sequenza nucleotidica del gene che codifica la transferasi B si è visto che essa è identica per il 99% a quella della transferasi A differendo per le mutazioni di solo 7 nucleotidi, di cui uno localizzato sul 6° esone e gli altri sei sul 7° esone. Tuttavia, solo le sostituzioni di 4 nucleotidi (C526G, G703A, C796A e G803C) sul 7° esone sono responsabili della modificazione aminoacidica nel dominio catalitico con conseguente diversa specificità della transferasi.
sequenza genomica del gruppo 0

Invece, per quanto riguarda la sequenza genomica del gruppo 0 essa differisce da quella di gruppo A per la delezione di una singola base a livello del nucleotide 261 (G261 -) sul 6° esone che causa uno sfasamento della cornice di lettura (reading frameshift). Le mutazioni frameshift derivano da un’inserzione o una delezione di un nucleotide in una sequenza codificante e possono essere: a) silenti: se nonostante la mutazione, non viene cambiato l’aminoacido codificato; b) missenso: se cambia l’aminoacido codificato da quel codone; c) non senso: se la sequenza che prima codificava per un aminoacido, ora codifica per un codone di stop causando la prematura terminazione della sintesi proteica dando luogo ad una transferasi inattiva da 116 aminoacidi.
Anche i diversi sottogruppi del sistema AB0 sono associati a mutazioni puntiformi o a delezioni a livello del 6° e del 7° esone del gene. E’ stato osservato, ancora, che il polimorfismo del gruppo ematico 0 può essere dovuto a diversi alleli.
Ad esempio, l’allele 02 può perdere la caratteristica delezione a livello del nucleotide 261, ma presentare tre sostituzioni nucleotidiche A297G, C526G e G802A, di cui solo l’ultima è la responsabile della sostituzione aminoacidica (glicina-arginina) con presumibile inattivazione enzimatica.
varianti minori
Sempre nell’ambito del sistema AB0, sono state descritte anche un certo numero di varianti minori. Tra queste, l’allele 03 è caratterizzato dalla perdita della mutazione predominante G261. Questo è indicativo del fatto che qualsiasi mutazione dei principali alleli delle transferasi A e B può essere in grado di inattivare la funzione enzimatica con possibile generazione di un allele 0.
Infine, anche per l’allele A2 è stata descritta una mutazione frameshift che determina la produzione di una transferasi con una coda C-terminale più lunga di 21 aminoacidi. Questa transferasi, oltre ad una differenza qualitativa, risulta essere meno efficiente rispetto a quella dell’allele A1.
Con l’introduzione delle tecniche di “next generation sequencing” o “NGS”, si è potuto individuare un numero maggiore di alleli al locus AB0, ciascuno dei quali può essere classificato come A, B, o 0 in termini di reazione trasfusionale, ma che può essere distinto da variazioni della sequenza del DNA.
Ci sono sei comuni alleli negli individui bianchi del gene AB0 che producono il proprio gruppo sanguigno.
18 alleli rari
Sono stati anche individuati 18 alleli rari che in genere hanno un’attività di glicosilazione più debole. Persone con alleli deboli A a volte possono esprimere anticorpi anti-A, anche se questi non sono solitamente significativi dal punto di vista clinico, non interagendo stabilmente a temperatura corporea con l’antigene. Un’altra variante rara è rappresentata dalla cis AB (una mutazione rara nel gene AB0) in cui i geni A e B sono trasmessi insieme da un unico genitore.
Allo stato attuale delle conoscenze, le ricerche di biologia molecolare effettuate sul sistema ABO hanno permesso di chiarire che:
1. I geni A e B codificano delle glicosiltransferasi che catalizzano su varie molecole lipidiche e proteiche l’inserimento di oligosaccaridi immunodominanti responsabili delle specificità antigeniche A e B, mentre il gene O dà origine ad una molecola sprovvista di tale attività enzimatica;
2. Le regioni codificanti degli alleli A e B mostrano tra loro un elevato grado di omologia (99%) e le differenze fra i due alleli si limitano a sette nucleotidi. Quattro di queste provocano cambiamenti nelle sequenze delle proteine codificate (transferasi) ed in particolare, provocano il cambiamento di quattro aminoacidi. Le altre tre sequenze nucleotidiche diverse sono silenti, ovvero non provocano nessun cambiamento nella sequenza aminoacidica delle transferasi;
3. Tutte queste sostituzioni aminoacidiche sono alla base della diversa specificità delle transferasi nelle reazioni zucchero-nucleotide che portano alla biosintesi degli antigeni A e B che risultano essere UDP-Nac gluc per l’antigene A e UDP-Gal per l’antigene B. In particolare, delle 4 sostituzioni aminoacidiche, la prima (arginina in A, glicina in B), non riveste importanza nella determinazione di questa specificità, la terza e la quarta sostituzione (leucina e glicina in A, metionina e alanina in B) e, in minor misura la seconda sostituzione, (glicina in A e serina in B) modificano la flessibilità delle due proteine. Questo sembra essere la causa delle due diverse specificità zucchero-nucleotide;
4. Nei soggetti con fenotipo O si ha la delezione di un singolo nucleotide che dà luogo ad uno spostamento della cornice di lettura (reading frameshift) che provoca la traduzione, da parte dell’RNAm, di una proteina enzimaticamente inattiva;
5. Differenze a livello delle sequenze nucleotidiche sono state individuate anche fra gli alleli Al e A2. In particolare, sono state identificate una sostituzione ed una delezione di singole basi nella sequenza codificante dell’ultimo esone dell’allele A2. La delezione della singola base è localizzata nella porzione che codifica la parte carbossi-terminale della transferasi, nella zona cioè dove risiede il sito attivo della proteina e questa sembra essere la causa della debole attività e della diversa cinetica di questa transferasi.
Conclusioni
Come si fa a definire il genotipo dal fenotipo?
-
Se un soggetto è di gruppo A, vuol dire che esprime l’antigene H e che possiede un enzima che permette di legare una molecola di α-N-acetilgalattosamina all’antigene H. Egli presenterà nel suo siero anticorpi anti-B;
-
Se un soggetto è di gruppo B, vuol dire che esprime l’antigene H e che possiede un enzima che permette di legare una molecola di galattosio all’antigene H. Egli presenterà nel suo siero anticorpi anti-A;
- Se un soggetto è di gruppo AB, significa che esprime l’antigene H e che possiede entrambi gli enzimi e dunque che alcuni antigeni H legheranno galattosio, altri N-acetilgalattosamina. Non presenterà nel suo siero né anti-A né anti B; a
-
Se un soggetto risulta di gruppo 0, non possiamo dire nulla sulla sua espressione degli enzimi precedentemente detti senza sapere quali anticorpi esprime: a) se esprime anticorpi anti-A e anti-B, allora il soggetto non esprimerà alcuno dei suddetti enzimi, ma le sue cellule esprimeranno un antigene H libero; questo è il gruppo 0 più comune; b) se esprime anticorpi anti-A, anti-B e anti H, allora il soggetto non è capace di esprimere l’antigene H, per cui, anche se genotipicamente può essere AA, BB, AB, A0 o B0, fenotipicamente risulterà 0, perché anche se possedesse uno dei suddetti enzimi, questi non avrebbero il loro substrato (antigene H) su cui legare galattosio o α-N-acetilgalattosamina;
La non espressione di antigene H si propaga con modalità autosomica recessiva (per cui da due genitori Hh la probabilità di ottenere prole che manifesterà fenotipo Bombay cioé con genotipo hh, è del 25%). Infine, per la presenza di anticorpi anti-H, il fenotipo Bombay può ricevere trasfusioni di sangue solo da un altro fenotipo Bombay.
Bibliografia:
- Landsteiner, K. Zentbl. Bakt. Parasitkde (Abt.) 27, 357-363 (1900).
- von Dungern, E. & Hirszfeld, L. Z. Immunitatsforsch. 8, 526-562 (1911).
- Bernstein, F. Klin. Wschr. 3, 1495-1497 (1924).
- Watkins, WM & Morgan, WTJ Vox Sang. 4, 97-119 (1959).
- Mage, Rose G.; Feizi, Ten (2004). “Elvin A. Kabat”. Biographical Memoirs. Vol. 85. National Academies Press. pp. 98–123
- Ten Feizi: “An appreciation of Elvin A. Kabat (1914-2000): Scientist, educator, and a founder of modern carbohydrate biology“
Sitografia
- https://www.google.it
- https://it.wikipedia.it

